
某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物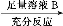 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是
A.溶液A和B均可以是盐酸或NaOH溶液
B.溶液A和B均可以选用稀硝酸
C.若溶液B选用浓硝酸,则测得铜的质量分数偏小
D.实验室方案Ⅱ更便于实施
科目:高中化学 来源:2016届内蒙古赤峰市宁城县高三上学期第一次统考化学试卷(解析版) 题型:实验题
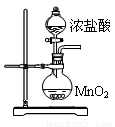
三氯化磷(PCl3)是一种重要的有机合成催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如下图所示。
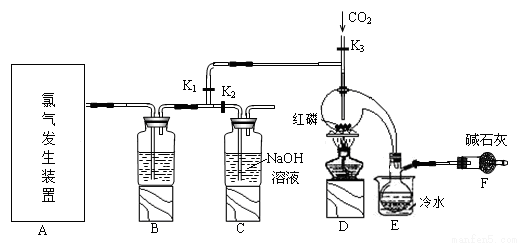
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见下表。
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | -112 | 75.5 |
POCl3 | 2 | 105.3 |
请答下面问题:
(1)B中所装试剂是 ,F中碱石灰的作用是 。
(2)实验时,检查装置气密性后,向D装置的曲颈甑中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈甑至上部有黄色升华物出现时通入氯气,反应立即进行。通干燥CO2的作用是 ,
(3)实验制得的粗产品中常含有POCl3、PCl5等。加入红磷加热除去PCl5后,通过 (填实验操作名称),即可得到较纯净的PCl3。
(4)C装置中的K1、K2的设计也出于类似的目的,为了达到这一实验目的,实验时与K1、K2有关的操作是 。
(5)实验后期关闭K1,打开K2,将气体通入C装置中发生反应,反应后的溶液为X。某同学设计实验来确定溶液X中含有的某些离子,请补充完成实验步骤和现象。
实验步骤 | 实验现象 | 实验结论 |
① | 溶液X中含有Na+ | |
② | 溶液X中含有Cl- |
(6)玻璃管之间的连接需要用到胶皮管,连接的方法是:先把 ,然后稍稍用力即可把玻璃管插入橡皮管。甲同学将装置A的示意图画成右图,该示意图中明显的错误是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏丹阳中学高二上10月月考化学试卷(解析版) 题型:填空题
(10分)现有下列各化合物:

(1)上述各组化合物属于同系物的是 ,属于同分异构体的是 (填入编号);
(2)A、B、C中的化合物中含有的官能团是(写名称) 、 、 、 ;
(3)根据官能团的特点可将C中两化合物划分为 类和 类。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一上期中测试化学试卷(解析版) 题型:选择题
工业上常用FeCl3溶液与铜反应制作印刷电路板。该反应的化学方程式为:2FeCl3+Cu =2FeCl2+CuCl2。取上述反应后溶液10 mL进行分析,测得其中c(Fe3+)为1mol·L—1。向其中加入足量的硝酸银溶液,过滤、干燥,可得到沉淀l7.22g。则上述反应后的10mL溶液中c(Cu2+)为
A.0.5mol·L—1 B.1.5 mol·L—1 C.0.4 mol·L—1 D.0.25 mol·L—1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上第一次月考化学试卷(解析版) 题型:选择题
在密闭容器中进行如下反应:X2(气) + Y2(气)  2Z(气), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L、0.3 mol/L、0.2 mol/L, 在一定的条件下, 当反应达到平衡时,各物质的浓度有可能是
2Z(气), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L、0.3 mol/L、0.2 mol/L, 在一定的条件下, 当反应达到平衡时,各物质的浓度有可能是
A.Y2为0.2 mol/L B.Y2 为0.35 mol/L
C.X2 为0.2 mol/L D. Z为 0.4 mol/L
查看答案和解析>>
科目:高中化学 来源:2016届河南省林州市高三上学期9月质检化学试卷(解析版) 题型:选择题
已知常温下Ksp(AgCl)=1.8×l0-10,Ksp(AgBr)=5×10 -13,下列有关说法错误的是
A.在饱和AgCl、AgBr的混合溶液中: = 360
= 360
B.向AgCl悬浊液中滴加浓NaBr溶液会产生淡黄色沉淀
C.AgCl在水中溶解度及Ksp均比在NaCl溶液中的大
D.欲用1 L NaCl溶液将0.01 mol AgBr转化为AgCl,则c(NaCl)≥3.61 mol/L
查看答案和解析>>
科目:高中化学 来源:2016届西藏拉萨中学高三上学期第二次月考化学试卷(解析版) 题型:填空题
(14分)氨是合成硝酸、铵盐和氮肥的基本原料,请问:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol•L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
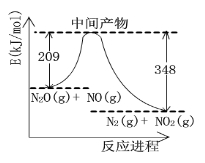
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示, 若生成1mol N2,其△H= kJ•mol-1。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上学期第一次段中考试化学试卷(解析版) 题型:填空题
原电池是化学对人类的一个重大贡献。
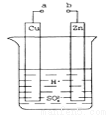
(1)某兴趣小组为研究原电池原理,设计如图所示装置。
①a和b不连接时,烧杯中发生的离子方程式是_____________,
②a和b用导线连接,Cu极为原电池____________极(填“正”或“负”),Zn极发生__________(填“氧化”或“还原”)反应。
③Zn片上发生的电极反应:________________,Cu片上发生的电极反应:________________。
(2)若a和b相连接,导线上转移0.2mol电子时,理论上Zn片质量减轻___________g。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省黄石市高二上学期10月月考化学试卷(解析版) 题型:填空题
家用炒菜铁锅用水清洗放置后,便会因腐蚀而出现红棕色的锈斑,铁锅发生腐蚀应属于 腐蚀,负极反应式为 ,正极反应式为 ,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com