
【题目】常温下,下列溶液中有关微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液:c(SO![]() )>c(NH
)>c(NH![]() )>c(Fe2+)>c(H+)
)>c(Fe2+)>c(H+)
B.在 0.1 mol·L-1Na2CO3 溶液中:c(OH-)=c(HCO![]() )+c(H2CO3)+c(H+)
)+c(H2CO3)+c(H+)
C.向Na2C2O4溶液中滴加HCl溶液至pH=7,所得溶液中: c(Cl-)=c(HC2O![]() )+2c(H2C2O4)
)+2c(H2C2O4)
D.pH=12 NaOH溶液与等体积pH=2的醋酸混合后的溶液:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
【答案】AC
【解析】
A.SO42-不水解,NH4+、Fe2+水解,但程度都较小,化学式中离子系数越大,则该离子在溶液中浓度越大,所以离子浓度大小顺序是c(SO42-)>c(NH4+)>c(Fe2+)>c(H+),故A正确;
B.根据电荷守恒得c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),物料守恒得c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),则c(OH-)=c(HCO![]() )+2c(H2CO3)+c(H+),故B错误;
)+2c(H2CO3)+c(H+),故B错误;
C.向Na2C2O4溶液中滴加HCl溶液至pH=7,则c(OH-)=c(H+),且存在电荷守恒式为c(OH-)+ c(Cl-)+ c(HC2O![]() )+2c(HC2O
)+2c(HC2O![]() )=c(H+)+ c(Na+),物料守恒为c(Na+)=2c(HC2O
)=c(H+)+ c(Na+),物料守恒为c(Na+)=2c(HC2O![]() )+2c(HC2O
)+2c(HC2O![]() )+2c(H2C2O4),将物料守恒代入电荷守恒得c(Cl-)=c(HC2O
)+2c(H2C2O4),将物料守恒代入电荷守恒得c(Cl-)=c(HC2O![]() )+2c(H2C2O4),故C正确;
)+2c(H2C2O4),故C正确;
D.0.01molL-1 NaOH溶液与等体积pH=2的醋酸溶液,c(CH3COOH)>c(NaOH),二者混合后,醋酸过量,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(CH3COO-)>c(Na+),溶液中的溶质是醋酸钠和醋酸,醋酸的电离程度很小,所以c(Na+)>c(H+),则溶液中离子浓度大小顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故D错误;
故答案为AC。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温下,回答下列关于盐酸和醋酸溶液的问题:
①对于![]() 的盐酸和
的盐酸和![]() 的醋酸溶液的pH:盐酸______
的醋酸溶液的pH:盐酸______![]() 选填“
选填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 醋酸,写出醋酸的电离方程式______
醋酸,写出醋酸的电离方程式______![]() 若用同浓度的NaOH溶液分别中和等体积且pH相等的盐酸和醋酸溶液,则消耗NaOH溶液的体积关系为:前者______后者
若用同浓度的NaOH溶液分别中和等体积且pH相等的盐酸和醋酸溶液,则消耗NaOH溶液的体积关系为:前者______后者![]() 选填“
选填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() .
.
②两种酸均能与氢氧化钠反应生成盐,其中醋酸能与氢氧化钠反应生成醋酸钠.实验室现有醋酸钠固体,取少量溶于水,溶液呈______![]() 选填“酸性”、“中性”或“碱性”
选填“酸性”、“中性”或“碱性”![]() ,其原因是
,其原因是![]() 用离子方程式表示
用离子方程式表示![]() ______.
______.
③向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的![]() 时,溶液中离子物质的量的浓度大小关系为______;当测得溶液的
时,溶液中离子物质的量的浓度大小关系为______;当测得溶液的![]() 时,溶液中离子物质的量的浓度大小关系可能为
时,溶液中离子物质的量的浓度大小关系可能为![]() 写出一种关系即可
写出一种关系即可![]() ______.
______.
④已知![]() 时,
时,![]() 的醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,发现溶液的pH增大.对上述现象有两种不同的解释:甲同学认为醋酸钠呈碱性,所以溶液的pH增大;乙同学给出另外一种不同于甲同学的解释,请你写出乙同学可能的理由______.
的醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,发现溶液的pH增大.对上述现象有两种不同的解释:甲同学认为醋酸钠呈碱性,所以溶液的pH增大;乙同学给出另外一种不同于甲同学的解释,请你写出乙同学可能的理由______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A. 工业制硫酸采用二氧化硫催化氧化,高温可以提高单位时间SO3的产量
B. 合成氨工业中使用铁触媒做催化剂
C. 用饱和食盐水除去氯气中氯化氢杂质
D. 容器中有2HI(g)![]() H2(g)+I2(g),增大压强颜色变深
H2(g)+I2(g),增大压强颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俄罗斯用“质子![]() ”号运载火箭成功将“光线”号卫星送入预定轨道,发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知下图:
”号运载火箭成功将“光线”号卫星送入预定轨道,发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知下图:
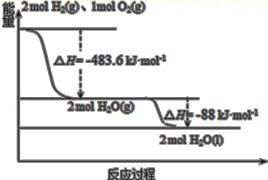
下列说法正确的是
A.2mol![]() 与1mol
与1mol![]() 所具有的总能量比
所具有的总能量比![]() 所具有的总能量低
所具有的总能量低
B.氢气的标准燃烧热为H=-285.8kJ/mol
C.火箭中液氢燃烧的热化学方程式为:2H2(l)+O2(l)=2H2O(g) H=-483.6kJ/mol
D.![]() 变成
变成![]() 的过程中,断键吸收的能量小于成键放出的能量
的过程中,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2具有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能发生反应。为了验证此推测结果,该同学设计并进行如下实验。
I.实验探究

步骤1:按如图所示的装置组装仪器(图中夹持仪器已省略)并检查装置的气密性,然后装入药品。
步骤2:打开K1、K2,在产生的氢气流经装有Na2O2的硬质玻璃管的过程中,未观察到明显现象。
步骤3:进行必要的实验操作,淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝色。
(1)组装好仪器后,要检查装置的气密性。简述检查虚线框内装置气密性的方法:________。
(2)B装置中所盛放的试剂是_____,其作用是_______。
(3)步骤3中的必要操作为打开K1、K2,_______(请按正确的顺序填入下列步骤的字母)。
A.加热至Na2O2逐渐熔化,反应一段时间
B.用小试管收集气体并检验其纯度
C.关闭K1
D.停止加热,充分冷却
(4)由上述实验可推出Na2O2与H2反应的化学方程式为__________。
II.数据处理
(5)实验结束后,该同学欲测定C装置硬质玻璃管内白色固体中未反应完的Na2O2含量。
其操作流程如下:
![]()
①测定过程中需要的仪器除固定、夹持仪器外,还有电子天平、烧杯、酒精灯、蒸发皿和____。
②在转移溶液时,若溶液转移不完全,则测得的Na2O2质量分数_____(填“偏大”“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是
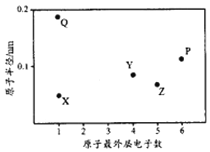
A. Q的氧化物一定含有离子键和共价键 B. 最高价含氧酸的酸性:Z<Y
C. P的最低价氢化物常温常压下为液体 D. Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液中存在多种平衡。请回答下列问题:
(1)已知:
化学式 | CH3COOH | HClO |
电离常数(25℃) | 1.8×10-5 | 3.0×10-8 |
物质的量浓度均为0.1mol/L的下列溶液:a. CH3COOH b. HClO ,比较二者C(H+)的大小:a______b(填“>”、“<”或“=”)。
(2)常温下,将 0.1mol/L 的 CH3COOH 溶液加水稀释,在稀释过程中,下列表达式的数值变大的 __________(填字母)。
A. c(H+) B.  C. c(H+)·c(OH-)
C. c(H+)·c(OH-)
(3)25℃时,体积均为 10mL,pH 均为 2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至 1000mL,稀释过程中 pH 的变化如图所示。已知:pH= -lgC(H+),则:

①25℃时,醋酸的电离常数________HX的电离常数。(填“>”、“<”或“=”)
②稀释100倍后, 醋酸溶液中由水电离出的 c(H+)________ HX溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4溶于水并和水反应:NaBH4+2H2O![]() NaBO2+4H2↑,下列说法中正确的是(提示:NaBH4中H 元素为1价)
NaBO2+4H2↑,下列说法中正确的是(提示:NaBH4中H 元素为1价)
A. NaBH4中的H得到电子,转化为H2
B. NaBH4中的Na失去1个电子
C. 硼元素被氧化,氢元素被还原
D. 被氧化与被还原的元素质量比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,取0.lmolL-1HA溶液与0.1molL-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因______(用离子方程式表示)。
(2)混合溶液中由水电离出的c(OH-)______0.1molL-1NaOH溶液中由水电离出的c(OH-)(填“>”、“<”或“=”)。
(3)所得混合液中各离子浓度从大到小的顺序为:______。
(4)混合液中:c(HA)+c(A-)=______molL-1。
(5)25℃时,已知NH4A溶液为中性,将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH______7(填“>”、“<”或“=”)。
(6)相同温度下相同物质的量浓度的下列四种盐溶液,pH由大到小的顺序______(填字母)。
A. NH4HCO3B. NH4AC. NH4HSO4D. NH4Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com