
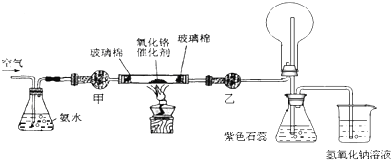
分析 (1)氨水的浓度为1:1.5,是体积比浓度,可以量取溶液体积混合得到,依据溶液配制的过程和步骤分析判断需要的玻璃仪器;
(2)甲处是干燥氨气需要用碱石灰,乙处是干燥一氧化氮气体用氯化钙;氨气不能用氯化钙干燥;
(3)氨气的催化氧化生成一氧化氮和水,反应是放热反应;
(4)缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中产生白烟.是因为氮氧化物和空气混合通入水中反应生成硝酸和过量氨气生成硝酸铵固体小颗粒;
(5)沸点低的易气化吸收热量,可以做制冷剂,冷冻物质沸点高的液化后可以做冷冻物质的物质.
解答 解:(1)氨水的浓度为1:1.5,是体积比浓度,可以量取溶液体积混合得到,利用量筒量取氨水和水在烧杯中混合后,用玻璃棒搅拌得到配制的溶液;
故答案为:量筒、烧杯、玻璃棒;
(2)甲处是干燥氨气需要用碱石灰,防止水蒸气进入玻璃管炸裂玻璃管,乙处是干燥一氧化氮气体用氯化钙,不吸收后再后续装置会生成白烟;氨气不能用氯化钙干燥;甲处:碱石灰;乙处:无水氯化钙;
故答案为:碱石灰;
(3)实验时,先将催化剂加热至红热,在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,反应是放热反应,发生的是氨气的催化氧化反应生成一氧化氮和水,反应的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(4)如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中产生白烟,氨气被氧化生成一氧化氮,一氧化氮和空气中的氧气反应生成二氧化氮,通入水中反应生成硝酸,硝酸和过量的氨气反应生成硝酸铵固体小颗粒,冒白烟;反应的很幸福陈楚生为:4NO+3O2+2H2O=4HNO3,或2NO+O2=2NO2和3NO2+H2O=2HNO3+NO或4NO2+O2+2H2O=4HNO3;NH3+HNO3=NH4NO3
故答案为:4NO+3O2+2H2O=4HNO3;2NO+O2=2NO2和3NO2+H2O=2HNO3+NO或4NO2+O2+2H2O=4HNO3;NH3+HNO3=NH4NO3;
(5)沸点低的易气化吸收热量,可以做制冷剂,冷冻物质沸点高的液化后可以做冷冻物质的物质,已知NH3和N2常压下的沸点分别为:-33.5℃和-195.8℃,据此推测这两种物质中,能做制冷剂的是氨气;能用来冷冻物质的是氮气,
故答案为:NH3.
点评 本题考查了氨气实验室制备,性质验证方法,氨气的催化氧化反应,气体干燥试剂选择,产物吸收,过程反应化学方程式的书写,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | 只有①③④ | C. | 只有①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H6、C4H10 | B. | CH4、C3H8 | C. | C2H4、C4H10 | D. | C3H8、C4H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
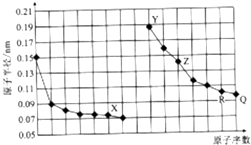
| A. | QX2、RX2都有杀菌消毒的作用,二者常用于自来水消毒 | |
| B. | 简单离子的半径:X>Y>Z | |
| C. | Y、Z、R对应的最高氧化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
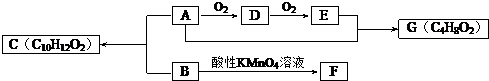
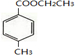 .
.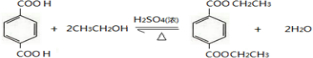 .
.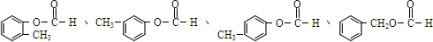 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4•5H2O | B. | FeSO4•7H2O | C. | KAl(SO4)2•12H2O | D. | Fe2(SO4)3•9H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔融不导电 | B. | 水溶液不导电 | ||
| C. | 熔点比BeBr2高 | D. | 不与NaOH溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com