
 ,其中取代基-Y中不含支链,含有碳碳双键,咖啡酸有如下转化关系:
,其中取代基-Y中不含支链,含有碳碳双键,咖啡酸有如下转化关系:
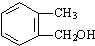 ,试写出D的属于芳香醇的其中2种同分异构体是
,试写出D的属于芳香醇的其中2种同分异构体是 ,与碳酸氢钠反应生成A为
,与碳酸氢钠反应生成A为 ,A与氢氧化钠反应生成B为
,A与氢氧化钠反应生成B为 ,(4)中D的芳香醇的一种同分异构体为
,(4)中D的芳香醇的一种同分异构体为 ,其它属于芳香醇的同分异构体,可以是甲基与-CH2OH有间位、对位,可以有1个侧链为-CH2CH2OH或-CH(OH)CH3,据此解答.
,其它属于芳香醇的同分异构体,可以是甲基与-CH2OH有间位、对位,可以有1个侧链为-CH2CH2OH或-CH(OH)CH3,据此解答. ,与碳酸氢钠反应生成A为
,与碳酸氢钠反应生成A为 ,A与氢氧化钠反应生成B为
,A与氢氧化钠反应生成B为 ,
, ,
, ;
; ,
, ;
; ,其它属于芳香醇的同分异构体,可以是甲基与-CH2OH有间位、对位,可以有1个侧链为-CH2CH2OH或-CH(OH)CH3,D的属于芳香醇的其它同分异构体有:
,其它属于芳香醇的同分异构体,可以是甲基与-CH2OH有间位、对位,可以有1个侧链为-CH2CH2OH或-CH(OH)CH3,D的属于芳香醇的其它同分异构体有: 、
、 、
、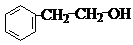 、
、 ,
, ;
; 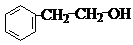 .
.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案科目:高中化学 来源: 题型:
| A、Na+ |
| B、PO43- |
| C、CO32- |
| D、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下.
某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下.查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 90 | 100 |
| KW/10-14 | 0.134 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 38.0 | 55.0 |
| 纯水 | 加少量盐酸 | 加少量NaOH | |
| c(H+) | 1.0×10-7 mol/L | 增大 | |
| c(OH-) | 1.0×10-7 mol/L | 增大 | |
| c(H+)和c(OH-)大小比较 | c(H+)=c(OH-) | c(H+) | c(H+) |
| 水的电离平衡移动方向 | |||
| KW值 | 1.0×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
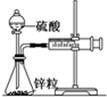 某温度下按如图安装好实验装置,在锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL 2.5mol?L-1的硫酸,将产生的H2收集在一个注射器中,用时10s时恰好收集到气体的体积为50mL(若折合成0℃、101kPa条件下的H2体积为44.8mL),在该温度下,下列说法不正确的是( )
某温度下按如图安装好实验装置,在锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL 2.5mol?L-1的硫酸,将产生的H2收集在一个注射器中,用时10s时恰好收集到气体的体积为50mL(若折合成0℃、101kPa条件下的H2体积为44.8mL),在该温度下,下列说法不正确的是( )| A、用锌粒表示10 s内该反应的速率为0.013 g?s-1 |
| B、忽略锥形瓶溶液体积的变化,用H+来表示10 s该反应的速率0.01 mol?(L?s)-1 |
| C、忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内反应的速率0.01 mol?(L?s)-1 |
| D、用H2表示10 s内该反应的速率为0.004 mol?(L?s)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1105 kJ |
| B、1812.5 kJ |
| C、2520 kJ |
| D、3935 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na和O2 |
| B、NaOH和CO2 |
| C、Na2O2和CO2 |
| D、木炭(C)和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤ | B、③⑤⑥ |
| C、③⑤ | D、②⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com