
°ĺŐ‚ńŅ°Ņ∂‘”ŕ ż“‘«ßÕÚľ∆ĶńĽĮ—ßőÔ÷ ļÕő™ żłŁ∂ŗĶńĽĮ—ß∑ī”¶£¨∑÷ņŗ∑®Ķń◊ų”√ľłļű «őřŅ…ŐśīķĶń£ģ»ÁÕľő™“Ľ°įŃī◊īѨĽ∑°ĪÕľįł£¨Õľįł…Ō”…◊ůĶĹ”“∑÷Īū–īŃňH2°ĘCO2°ĘNa2O°ĘNaCl°ĘFeCl3őŚ÷÷őÔ÷ £¨Õľ÷–ŌŗѨĶńŃĹ÷÷őÔ÷ ĺýŅ…Ļť Űő™“Ľņŗ£¨ŌŗĹĽ≤Ņ∑÷”…◊ůĶĹ”“A°ĘB°ĘC°ĘDő™∆šŌŗ”¶Ķń∑÷ņŗ“ņĺ›īķļŇ£ģ
«ŽĽōīūŌ¬Ń–ő Ő‚£ļ
£®1£©«ŽĹę∑÷ņŗ“ņĺ›īķļŇŐÓ»ŽŌŗ”¶Ķńņ®ļŇńŕ£ģ
ŃĹ÷÷őÔ÷ ∂ľ≤Ľ «ĶÁĹ‚÷
ŃĹ÷÷őÔ÷ ∂ľ «ń∆ĶńĽĮļŌőÔ
ŃĹ÷÷őÔ÷ ∂ľ «—űĽĮőÔ
ŃĹ÷÷őÔ÷ ∂ľ «—ő
£®2£©”√ĹŗĺĽĶń…’Ī≠»°…ŔŃŅ’ŰŃůňģ£¨”√ĺ∆ĺęĶ∆ľ”»»÷Ń∑–Őŕ£¨ŌÚ…’Ī≠÷–÷ūĶőľ”»Ž1molL©Ā1Ķń…ŌÕľ÷–“Ľ÷÷ĽĮļŌőÔĶńňģ»‹“ļ£¨Ņ…÷∆Ķ√“Ľ÷÷ļž…ęĹļŐŚ£ģ
ĘŔ∑ī”¶ĶńĽĮ—ß∑Ĺ≥Ő Ĺő™ £ģ
Ęŕ»Áļő”√ĹŌľÚĶ•Ķń∑Ĺ∑®Ň–∂ŌĹļŐŚ «∑Ů÷∆Īł≥…Ļ¶£Ņ £ģ
ĘŘŌÚł√ĹļŐŚ÷–÷ūĶőľ”»ŽHIŌ°»‹“ļ£¨ĽŠ≥ŲŌ÷“ĽŌĶŃ–ĪšĽĮ£ļ
a£ģŌ»≥ŲŌ÷ļžļ÷…ę≥ŃĶŪ£¨‘≠“Ú « £ģ
b£ģňśļůļžļ÷…ę≥ŃĶŪ»‹Ĺ‚£¨īň∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺ « £ģ ![]()
°ĺīūįł°Ņ
£®1£©A£ĽC£ĽB£ĽD
£®2£©FeCl3+3H2O ![]() Fe£®OH£©3£®ĹļŐŚ£©+3HCl£Ľ»Űł√∑÷…ĘŌĶń‹≤ķ…ķ∂°īÔ∂Ż–ß”¶£¨‘Ú÷∆Īł≥…Ļ¶£Ľ∑Ů‘Ú£¨≤Ľ≥…Ļ¶£ĽĶÁĹ‚÷ »‹“ļ«‚Ķ‚ňŠ ĻFe£®OH£©3ĹļŐŚ∑Ę…ķĺŘ≥Ń£¨≤ķ…ķFe£®OH£©3≥ŃĶŪ£Ľ2Fe£®OH£©3+2I©Ā+6H+=2Fe2++I2+3H2O
Fe£®OH£©3£®ĹļŐŚ£©+3HCl£Ľ»Űł√∑÷…ĘŌĶń‹≤ķ…ķ∂°īÔ∂Ż–ß”¶£¨‘Ú÷∆Īł≥…Ļ¶£Ľ∑Ů‘Ú£¨≤Ľ≥…Ļ¶£ĽĶÁĹ‚÷ »‹“ļ«‚Ķ‚ňŠ ĻFe£®OH£©3ĹļŐŚ∑Ę…ķĺŘ≥Ń£¨≤ķ…ķFe£®OH£©3≥ŃĶŪ£Ľ2Fe£®OH£©3+2I©Ā+6H+=2Fe2++I2+3H2O
°ĺĹ‚őŲ°ŅĹ‚£ļ£®1£©ĶÁĹ‚÷ «‘ŕňģ»‹“ļ÷–ĽÚ»Ř»ŕ◊īŐ¨Ō¬ń‹ĶľĶÁĶńĽĮļŌőÔ£¨ĶÁĹ‚÷ įŁņ®ňŠ°ĘľÓ°Ę—ő°ĘĹū Ű—űĽĮőÔļÕňģ£¨Ļ H2°ĘCO2≤Ľ «ĶÁĹ‚÷ £¨—°A£Ľ
ļ¨”–ń∆‘™ňōĶńĽĮļŌőÔ≥∆ő™ń∆ĶńĽĮļŌőÔ£¨Ļ Na2O°ĘNaClő™ń∆ĶńĽĮļŌőÔ£¨—°C£Ľ
ŃĹ÷÷‘™ňō◊ť≥…£¨∆š÷–“Ľ÷÷ «—ű‘™ňōĶńĽĮļŌőÔ£¨CO2°ĘNa2Oő™—űĽĮőÔ£¨—°B£Ľ
—ő «—ŰņŽ◊” «Ĺū ŰņŽ◊”ĽÚÔßłýņŽ◊”£¨“űņŽ◊” «ňŠłýņŽ◊”ĶńĽĮļŌőÔ£¨Ļ NaCl°ĘFeCl3ő™—ő£¨—°D£Ľ
ňý“‘īūįł «£ļA°ĘC°ĘB°ĘD£Ľ£®2£©ĘŔ÷∆ĪłĹļŐŚĶń‘≠ņŪ «ņŻ”√ŐķņŽ◊”ňģĹ‚…ķ≥…«‚—űĽĮŐķĹļŐŚ£¨∑ī”¶ĶńĽĮ—ß∑Ĺ≥Ő Ĺő™FeCl3+3H2O ![]() Fe£®OH£©3£®ĹļŐŚ£©+3HCl£Ľ
Fe£®OH£©3£®ĹļŐŚ£©+3HCl£Ľ
ňý“‘īūįł «£ļFeCl3+3H2O ![]() Fe£®OH£©3£®ĹļŐŚ£©+3HCl£Ľ
Fe£®OH£©3£®ĹļŐŚ£©+3HCl£Ľ
Ę໋“ļ≤Ľ≤ķ…ķ∂°īÔ∂Ż–ß”¶£¨∂Ý«‚—űĽĮŐķĹļŐŚń‹≤ķ…ķ∂°īÔ∂Ż–ß”¶£¨
ňý“‘īūįł «£ļ»Űł√∑÷…ĘŌĶń‹≤ķ…ķ∂°īÔ∂Ż–ß”¶£¨‘Ú÷∆Īł≥…Ļ¶£Ľ∑Ů‘Ú£¨≤Ľ≥…Ļ¶£Ľ
ĘŘa°Ęľ”»ŽĶÁĹ‚÷ ļů£¨Fe£®OH£©3ĹļŐŚ∑Ę…ķĺŘ≥Ń£¨ĶÁĹ‚÷ »‹“ļ«‚Ķ‚ňŠ ĻFe£®OH£©3ĹļŐŚ∑Ę…ķĺŘ≥Ń£¨≤ķ…ķFe£®OH£©3≥ŃĶŪ£Ľ
ňý“‘īūįł «£ļĶÁĹ‚÷ »‹“ļ«‚Ķ‚ňŠ ĻFe£®OH£©3ĹļŐŚ∑Ę…ķĺŘ≥Ń£¨≤ķ…ķFe£®OH£©3≥ŃĶŪ£Ľ
b°Ęňśļů≥ŃĶŪ»‹Ĺ‚£¨»‹“ļ≥ Ľ∆…ę£¨’‚ ««‚—űĽĮŐķĪĽHI»‹Ĺ‚ňý÷¬£¨∑Ę…ķ—űĽĮĽĻ‘≠∑ī”¶£¨īň∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺő™£ļ2Fe£®OH£©3+2I©Ā+6H+=2Fe2++I2+3H2O£¨
ňý“‘īūįł «£ļ2Fe£®OH£©3+2I©Ā+6H+=2Fe2++I2+3H2O£Ľ


 —ßŃ∑Ņž≥ĶĶņŅžņ÷ľŔ∆ŕļģľŔ◊ų“ĶŌĶŃ–īūįł
—ßŃ∑Ņž≥ĶĶņŅžņ÷ľŔ∆ŕļģľŔ◊ų“ĶŌĶŃ–īūįł
| ńÍľ∂ | łŖ÷–Ņő≥Ő | ńÍľ∂ | ≥ű÷–Ņő≥Ő |
| łŖ“Ľ | łŖ“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű“Ľ | ≥ű“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ∂Ģ | łŖ∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű∂Ģ | ≥ű∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ»ż | łŖ»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű»ż | ≥ű»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° |
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ“—÷™A°ĘB°ĘC°ĘD∂ľ «∂Ő÷‹∆ŕ‘™ňō£¨ňŁ√«Ķń‘≠◊”įŽĺ∂īů–°ő™B£ĺC£ĺD£ĺA°£BĶńĽýŐ¨‘≠◊”÷–ĶÁ◊”’ľĺ›»ż÷÷ń‹ŃŅ≤ĽÕ¨Ķń‘≠◊”ĻžĶņ£¨«“√Ņ÷÷ĻžĶņ÷–ĶńĶÁ◊”◊‹ żŌŗÕ¨£ĽD‘≠◊””–2łŲőī≥…∂‘ĶÁ◊”°£A°ĘB°ĘD»ż÷÷‘™ňō◊ť≥…Ķń“Ľ÷÷ĽĮļŌőÔM «–¬◊į–řĺ” “÷–≥£ļ¨”–Ķń“Ľ÷÷”–ļ¶∆ÝŐŚ°£E «Ķŕňń÷‹∆ŕ‘™ňō£¨∆š‘≠◊”ļňÕ‚◊ÓÕ‚≤„ĶÁ◊” ż”ŽA‘≠◊”ŌŗÕ¨£¨∆š”ŗłų≤„ĶÁ◊”ĺý≥š¬ķ°£ĽōīūŌ¬Ń–ő Ő‚£®”√‘™ňō∑ŻļŇĽÚĽĮ—ß ĹĪŪ ĺ£©°£
£®1£©M∑÷◊”÷–B‘≠◊”ĻžĶņĶń‘”ĽĮņŗ–Õő™ °£
£®2£©ĽĮļŌőÔCA3Ķń∑–Ķ„Ī»ĽĮļŌőÔBA4ĶńłŖ£¨∆š÷ų“™‘≠“Ú « °£
£®3£©–ī≥Ų”ŽBD2Ľ•ő™Ķ»ĶÁ◊”ŐŚĶńC3£≠ĶńĹŠĻĻ Ĺ °£
£®4£©E+ĶńļňÕ‚ĶÁ◊”ŇŇ≤ľ Ĺő™ £¨Ō¬Õľ «D°ĘE–ő≥…Ķńń≥÷÷ĽĮļŌőÔĶńĺßįŻĹŠĻĻ ĺ“‚Õľ£¨ł√ĺßŐŚ1łŲĺßįŻ÷–—ŰņŽ◊”ĶńłŲ żő™ °£

£®5£©ŌÚEĶńŃÚňŠ—ő»‹“ļ÷–Õ®»ŽĻżŃŅĶńCA3£¨Ņ……ķ≥…[E(CA3)4]2+ŇšņŽ◊”£¨1 mol [E(CA3)4]2+÷–ļ¨”–¶“ľŁĶń żńŅő™ °£
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņt°ś Ī£¨Ĺę2mol SO2ļÕ1mol O2Õ®»ŽŐŚĽżő™2LĶńļ„ő¬ļ„»›√‹Ī’»›∆ų÷–£¨∑Ę…ķ»ÁŌ¬∑ī”¶£ļ2SO2£®g£©+O2£®g£©2SO3£®g£©£¨2min Ī∑ī”¶īÔĶĹĽĮ—ß∆Ĺļ‚£¨īň Ī≤‚Ķ√∑ī”¶őÔO2ĽĻ £”ŗ0.2mol£¨«ŽŐÓ–īŌ¬Ń–Ņ’į◊£ļ
£®1£©ī”∑ī”¶Ņ™ ľĶĹĽĮ—ß∆Ĺļ‚£¨…ķ≥…SO3Ķń∆Ĺĺý∑ī”¶ňŔ¬ ő™£Ľ∆Ĺļ‚ ĪSO2◊™ĽĮ¬ ő™ £ģ
£®2£©Ō¬Ń––ū Ųń‹÷§√ųł√∑ī”¶“—īÔĶĹĽĮ—ß∆Ĺļ‚◊īŐ¨Ķń « £ģ
A.»›∆ųńŕ—Ļ«Ņ≤Ľ‘Ŕ∑Ę…ķĪšĽĮ
B.SO2ĶńŐŚĽż∑÷ ż≤Ľ‘Ŕ∑Ę…ķĪšĽĮ
C.»›∆ųńŕ∆ÝŐŚ‘≠◊”◊‹ ż≤Ľ‘Ŕ∑Ę…ķĪšĽĮ
D.ŌŗÕ¨ ĪľšńŕŌŻļń2n mol SO2ĶńÕ¨ ĪŌŻļńn mol O2
E.ŌŗÕ¨ ĪľšńŕŌŻļń2n mol SO2ĶńÕ¨ Ī…ķ≥…n mol O2
£®3£©t°ś Ī£¨ł√∑ī”¶Ķń∆Ĺļ‚≥£ żő™
£®4£©t1°ś Ī£¨»ŰĹęőÔ÷ ĶńŃŅ÷ģĪ»n£®SO2£©£ļn£®O2£©=1£ļ1ĶńĽžļŌ∆ÝŐŚÕ®»Ž“ĽłŲļ„ő¬ļ„—ĻĶń√‹Ī’»›∆ų÷–£¨∑ī”¶īÔĶĹ∆Ĺļ‚ Ī£¨ĽžļŌ∆ÝŐŚŐŚĽżľű…ŔŃň10%£ģSO2Ķń◊™ĽĮ¬ ő™ £ģ
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅĹꬻĽĮń∆ľ”»»÷ѻػŕ◊īŐ¨ļůĹÝ––ĶÁĹ‚£¨Ņ…Ķ√ĶĹĹū Űń∆”Ž¬»∆Ý£¨īňĻż≥Ő÷–
A.∆∆ĽĶŃňĹū ŰľŁB.∆∆ĽĶŃňĻ≤ľŘľŁ
C.–ő≥…ŃňņŽ◊”ľŁD.–ő≥…ŃňĻ≤ľŘľŁ
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅÓť «“Ľ÷÷¬Ő…ęŌ°”–Ĺū Ű£¨Óťľį∆šĽĮļŌőÔ‘ŕĻ§“Ķ…ķ≤ķ÷–”√ÕĺĻ„∑ļ£¨Ļ§“Ķ…Ō≥£≤…”√ī÷ÓťĺęŃ∂÷∆Ķ√”√Õ峣ő™Ļ„∑ļĶńĺęŃ∂Óť(ļ¨Óť99.995%),Ľū∑®ĺęŃ∂ÓťĶńĻ§“’Ńų≥Ő»ÁŌ¬:
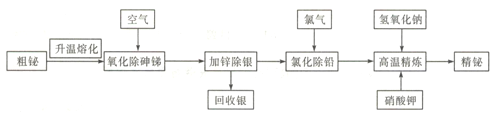
“—÷™:ĘŔī÷Óť(«¶ÓťļŌĹū)Ķń÷ų“™ĽĮ—ß≥…∑÷»ÁŌ¬ĪŪ£ļ
‘™ňō | Ag | Bi | Pb | As | Sb |
ļ¨ŃŅ/% | 0.90 | 55.25 | 27 | 1.30 | 11 |
Ę଻ĽĮ«¶»ŘĶ„ő™498°ś£¨√‹∂»ő™5.9g/cm3£ĽÓťĶń»ŘĶ„ő™271°ś£¨∑–Ķ„ő™1470°ś£ĽBiCl3Ķń»ŘĶ„ő™506.5°ś°£
ĘŘ–ŅňŠ—őľÚ–ī≥…ZnO22-£¨»Á–ŅňŠń∆Na2ZnO2°£
Ę‹+3ľŘÓťĶńĽĮļŌőÔĹŌő™ő»∂®£¨ÓťňŠń∆ń—»‹”ŕňģ°£
ĽōīūŌ¬Ń–ő Ő‚:
£®1£© Ķ—ť “÷–…żő¬»ŘĽĮī÷Óť“Ľį„”√ĺ∆ĺęŇÁĶ∆‘ŕ________(ŐÓ÷ų“™“«∆ų√Ż≥∆)÷–ÕÍ≥…°£
£®2£©NaBiO3÷–Óť‘™ňōĶńĽĮļŌľŘő™________°£
£®3£©°į—űĽĮ≥ż…ťŐŗ°ĪĶńĻ§“’ĽķņŪ «ī÷Óť»Ř»ŕ“ļ‘ŕ680~750°śĶńŐűľĢŌ¬£¨Ļń»Ž—ĻňűŅ’∆Ý£¨ Ļ…ť°ĘŐŗ—űĽĮĽ”∑Ę£¨Õ¨ ĪŅ’∆Ý“≤”ŽÓť“ļ∑ī”¶£¨ņŻ”√Bi2O3Ķń_______–‘Ĺę‘”÷ …ť°ĘŐŗ◊™Īš≥…As2O3°ĘSb2O3∂Ý≥ż»•°£
£®4£©°į¬»ĽĮ≥ż«¶°ĪĻż≥Ő÷–£¨¬»∆Ý”Ž«¶°ĘÓť∑ī”¶∑÷Īū…ķ≥…PbCl2°ĘBiCl3£¨…ķ≥…ĶńBiCl3”÷ĽŠĪĽ«¶ĽĻ‘≠£¨∑Ę…ķ∑ī”¶3Pb+2BiCl3=3PbC12+2Bi£¨Ņō÷∆ő¬∂»350-400°ś£¨ņŻ”√»ŘĶ„ļÕ√‹∂»ŐōĶ„£¨¬»ĽĮ«¶…Ōł°÷ŃÓť“ļĪŪ√ś≥ _______Ő¨ł≤ł«£¨∑ņ÷Ļ¬»∆Ý__________________°£
£®5£©łŖő¬ĺęŃ∂Ķń Ķ÷ ő™ľÓ–‘ĺęŃ∂£¨ľ”»Ž…ŔŃŅKNO3ļÕNaOH£¨Ĺę–Ņ—űĽĮ≥…–ŅňŠ—ő∂Ý≥ż»•≤––Ņ£¨Õ¨ ĪĶ√ĶĹĶ™∆Ý£¨–ī≥ŲłŖő¬ĺęŃ∂ĶńĽĮ—ß∑Ĺ≥Ő Ĺ: __________________°£
£®6£©ŌÚļ¨”–MnSO4ĶńňŠ–‘»‹“ļ÷–ľ”»ŽÓťňŠń∆∑Řń©£¨»‹“ļĪšő™◊Ōļž…ę£¨ł√∑ī”¶ĺ≠≥£”√ņīľž—ťMn2+£¨–ī≥Ųł√∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺ__________________°£
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŌ¬Ń–őÔ÷ Ű”ŕ”–ĽķőÔĶń «
A. ŃÚňŠ B. ŐľňŠ C. ī◊ňŠ D. “Ľ—űĽĮŐľ
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ≥£ő¬Ō¬£¨»°pH=2Ķń—őňŠļÕī◊ňŠ»‹“ļłų100mL,ŌÚ∆š÷–∑÷Īūľ”»Ž ŃŅĶńZnŃ££¨∑ī”¶Ļż≥Ő÷–ŃĹ»‹“ļĶńpHĪšĽĮ»Á”“Õľňý ĺ°£Ō¬Ń–ňĶ∑®≤Ľ’ż»∑Ķń «
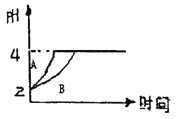
A. Õľ÷–ĪŪ ĺī◊ňŠ»‹“ļ÷–pHĪšĽĮ«ķŌŖĶń «B
B. …Ť—őňŠļÕī◊ňŠ÷–ľ”»ŽĶńZn÷ ŃŅ∑÷Īūő™m1°Ęm2,‘Úm1<m2
C. pH=2 Ī—őňŠļÕī◊ňŠĶńőÔ÷ ĶńŃŅ«į’Ŗ–°
D. pH=4 ĪŃĹ»‹“ļc(Zn2+)ŌŗĶ»
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅĪŪő™‘™ňō÷‹∆ŕĪŪĶń“Ľ≤Ņ∑÷£¨«Ž”√ĽĮ—ß”√”ÔĽōīū”–Ļōő Ő‚£ļ
◊Ś | ĘŮA | ĘÚA | ĘůA | ĘŰA | ĘűA | ĘŲA | ĘųA | 0 |
2 | ĘŔ | Ęŕ | ||||||
3 | ĘŠ | ĘŘ | Ę‹ | Ę› | Ęř | ĘŖ | Ęŗ |
£®1£©ĘŔļÕĘŗĶń‘™ňō∑ŻļŇ «ļÕ£Ľ
£®2£©‘™ňōĘř–ő≥…Ķń«‚ĽĮőÔĶńĶÁ◊” Ĺ «£Ľ
£®3£©ĪŪ÷–ń‹–ő≥…ŃĹ–‘«‚—űĽĮőÔĶń‘™ňō «£®ŐÓ–ī‘™ňō∑ŻļŇ£©£¨«Ž–ī≥Ųł√‘™ňōĶń«‚—űĽĮőÔ”ŽĘŠ◊ÓłŖľŘ—űĽĮőÔ∂‘”¶ĶńňģĽĮőÔ∑Ę…ķ∑ī”¶ĶńĽĮ—ß∑Ĺ≥Ő Ĺ £ģ
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŌ¬Ń–ņŽ◊”∑Ĺ≥Ő Ĺ–ī’ż»∑Ķń «
A. ĮĽ“ Į…ŌĶőľ”Ō°ī◊ňŠ: CaCO3+2H+=Ca2++ H2O+CO2°Ł
B. ŌÚ∑–ňģ÷–Ķőľ”FeCl3»‹“ļ÷∆Fe(OH)3ĹļŐŚ: Fe3++3H2O ![]() Fe(OH)3°ż+ 3H+
Fe(OH)3°ż+ 3H+
C. …ŔŃŅSO2Õ®»ŽCa(ClO)2»‹“ļ÷–: SO2+ H2O + Ca2++ 2ClO-= CaSO3°ż+2HClO
D. ≥ő«Ś ĮĽ“ňģ”Ž…ŔŃŅ–°ň’īÚ»‹“ļĽžļŌ: Ca2++ OH-+ HCO3-=CaCO3°ż+ H2O
≤ťŅīīūįłļÕĹ‚őŲ>>
įŔ∂»÷¬–Ň - Ń∑Ōį≤ŠŃ–ĪŪ - ‘Ő‚Ń–ĪŪ
ļĢĪĪ °Ľ•Ń™ÕÝő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®∆ĹŐ® | ÕÝ…Ō”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | ĶÁ–Ň’©∆≠ĺŔĪ®◊®«Ý | …śņķ ∑–ťőř÷ų“Ś”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | …ś∆ů«÷»®ĺŔĪ®◊®«Ý
ő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®ĶÁĽį£ļ027-86699610 ĺŔĪ®” Ōš£ļ58377363@163.com