
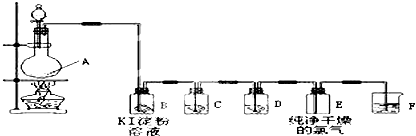
| ||
| ||
| ||


 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д� �����Ծ���ĩ���100��ϵ�д�
�����Ծ���ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� |
| ���� |
| ��Ӧʱ��/min | n��NO2��/mol | n��NH3��/mol |
| 0 | 1.20 | 1.60 |
| 2 | 0.80 | |
| 4 | 0.40 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Na+��K+��Cu2+��SO42- |
| B��NH4+��Na+��NO3-��Cl- |
| C��K+��Ca2+��HCO3-��Cl- |
| D��Mg2+��Na+��Cl-��OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2HI��g��?H2��g��+I2��g����H��0 |
| B��N2��g��+3H2��g��?2NH3��g����H��0 |
| C��C��s��+H20��g��?C0��g��+H2��g����H��0 |
| D��2S03?2S0��g��+02��g����H��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��x+y��z |
| B��ƽ�����淴Ӧ�����ƶ� |
| C��B��ת���ʽ��� |
| D��C������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ŵ�ʱ��Һ�е��������������ƶ� |
| B��������ӦʽΪ��CH4+10OH--8e-=CO32-+7H2O |
| C�����ŷŵ�Ľ��У���Һ��pH���� |
| D��������ӦʽΪ��O2+2H2O+4e=4OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
48 22 |
50 22 |
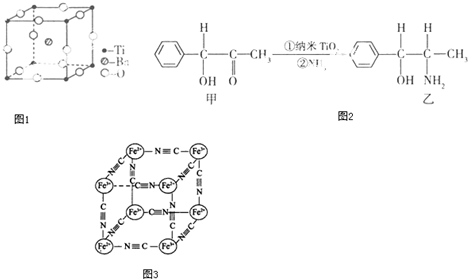
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com