
| A. | 中和热测定实验用的小烧杯和物质的量浓度溶液配制用的容量瓶都必须干燥 | |
| B. | 用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液,若滴定终点时仰视读数,测得氢氧化钠浓度偏低 | |
| C. | 配制2.0 mol•L-1的硫酸,若定容时俯视,则所得溶液浓度偏高(其他操作均正确) | |
| D. | 用铜电极电解2.0 mol•L-1的硫酸,阴阳两极生成气体的体积之比为2:1 |
分析 A.容量瓶用于盛装溶液,无需干燥;
B.若滴定终点时仰视读数,导致体积偏大;
C.若定容时俯视,导致体积偏小;
D.用铜电极电解,阳极上铜被氧化.
解答 解:A.中和热测定时烧杯需要干燥,容量瓶用于盛装溶液,无需干燥,故A错误;
B.若滴定终点时仰视读数,导致体积偏大,则导致测定的浓度偏大,故B错误;
C.若定容时俯视,导致体积偏小,导致浓度偏大,故C正确;
D.用铜电极电解,阳极上铜被氧化,阳极上不生成气体,故D错误.
故选C.
点评 本题考查较为综合,涉及溶液的配制、中和滴定、中和热的测定以及电解等知识,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的合理性以及严密性的评价,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 将铜屑加入Fe3+溶液中:2Fe3++Cu═2Fe2++Cu2+ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| C. | 氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- | |
| D. | 将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫原子的原子结构示意图: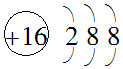 | |
| B. | NH4Cl的电子式: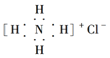 | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | HBr的形成过程: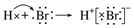 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>Z>Q>W | |
| B. | 最高价氧化物对应的水化物的酸性:Z<Q | |
| C. | Q和W可形成原子个数比为1:1和1:2的化合物 | |
| D. | X、Y和W三种元素形成的化合物的水溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ①盐泥a除泥沙外,还含有的物质是Mg(OH)2.
①盐泥a除泥沙外,还含有的物质是Mg(OH)2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 相对分子质量 | 性质 |
| 废饮料瓶碎片 | 聚对苯二甲酸乙二醇酯:乳白色或浅黄色的聚合物. | |
| 乙二醇(EG) | 62 | 无色无臭液体,对动物有毒性.沸点:196~198℃,与水混溶. |
对苯二甲酸(TPA) | 166 | 白色晶体或粉末,低毒.弱酸.300℃以上升华.不溶于水、乙醚、氯仿等大多数有机溶剂,可溶于DMF等强极性有机溶剂. |
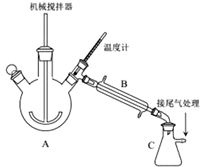
 .
. ,生产时,若消耗EG的物质的量比TPA多4‰,则上述聚合物的链节数n为250.
,生产时,若消耗EG的物质的量比TPA多4‰,则上述聚合物的链节数n为250.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
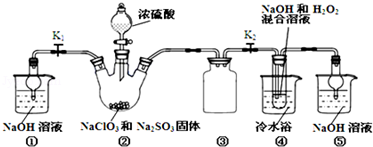
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com