
| A. | CH3-CH═CH2 | B. | 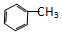 | C. | CH3-CH3 | D. | 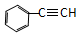 |
分析 在常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行共线、共面分析判断,注意单键可以旋转,以此解答该题.
解答 解:A.丙烯中含有甲基,具有四面体结构,所以原子不可能处于同一平面,故A错误;
B.甲苯中含有甲基,具有四面体结构,所以原子不可能处于同一平面,故B错误;
C.乙烷为饱和烃,所有原子不可能在同一个平面上,故C错误;
D.苯环具有平面形结构,碳碳三键具有直线形结构,可位于同一平面,故D正确.
故选D.
点评 本题主要考查有机化合物的结构特点,为高频考点,侧重于学生的分析能力的考查,做题时注意从甲烷、乙烯、苯和乙炔的结构特点判断有机分子的空间结构,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 尿素作为一种中性肥料,适用于各种土壤和植物.它易保存,使用方便,对土壤的破坏作用小,是目前使用量较大的一种化学氮肥.
尿素作为一种中性肥料,适用于各种土壤和植物.它易保存,使用方便,对土壤的破坏作用小,是目前使用量较大的一种化学氮肥.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 静置后的淘米水能产生丁达尔现象,这种“淘米水”是胶体 | |
| B. | “洁厕灵”有效成分为盐酸,与漂白粉混合使用效果更佳 | |
| C. | 新型能源生物柴油和矿物油主要化学成分相同 | |
| D. | 铝热反应中可得到铁,工业上可以利用该反应来大量生产铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | 0 | 2 | 4 | 6 | 8 | 10 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油 | B. | 馒头 | C. | 牛肉 | D. | 橙子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
实验 序号 | 时间 浓度 温 度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | c1 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | 1.0 | c2 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com