
科目:高中化学 来源: 题型:选择题
| A. | 将氯化钠固体加热到熔融状态产生Na+和Cl- | |
| B. | 将碘单质加热升华 | |
| C. | 将氯化氢气体通入水产生H+和Cl- | |
| D. | 在放电条件下氧气转化为臭氧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 1 L 0.1 mol•L-1的氨水中有0.1NA个NH4+ | |
| C. | 常温常压下,8 g O2含有4 NA个电子 | |
| D. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
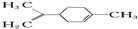 有关柠檬烯的分析正确的是( )
有关柠檬烯的分析正确的是( )| A. | 它的一氯代物有6种 | |
| B. | 它和丁基苯( 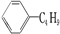 )互为同分异构体 )互为同分异构体 | |
| C. | 它的分子中所有的碳原子一定在同一平面上 | |
| D. | 一定条件下,它分别可以发生加成、取代、氧化、还原等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.
硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示在密封容器中,一部分装入2.3g金属钠,另一部分装入HgO,同时加热两部分,若加热后容器内的空气成分未变,那么装入容器中的HgO是( )
如图所示在密封容器中,一部分装入2.3g金属钠,另一部分装入HgO,同时加热两部分,若加热后容器内的空气成分未变,那么装入容器中的HgO是( )| A. | 21.6 g | B. | 20.0g | C. | 1.6 g | D. | 10.8 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com