
(10分)利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下:
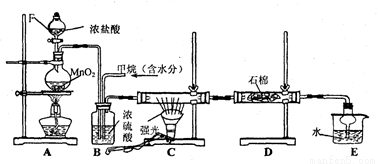
根据要求填空:
(1)装置A中反应的化学方程式为 ,当产生336mL气体(标准状况)时,有 mol还原剂被氧化。
(2)B装置有三种功能:①控制气流速度;②_______;③________________。
(3)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x的取值范围是______。
(4)D装置中的石棉上均匀附着KI粉末,其作用是_______________________。
(5)E装置的作用是____________(填编号)。
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(6)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式_______________________________。
(7)装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为_______。该装置还有缺陷,原因是没有进行尾气处理,其尾气的主要成分是__________(填编号)。
A.CH4
B.CH3Cl
C.CH2Cl2
D.CHCl3
E.CCl4
(10分)(1) MnO2 +4HCl(浓) MnCl2 + Cl2↑+2H2O(1分), 0.030(1分)。
MnCl2 + Cl2↑+2H2O(1分), 0.030(1分)。
(2)使气体混合均匀(1分);干燥气体(1分); (3)≥4(1分);
(4)吸收过量的Cl2(1分), (5)CD(1分);
⑹CH4+2Cl2→C+4HCl(1分); ⑺分液(1分), AB(1分)。
【解析】
试题分析:(1)装置A为制取氯气的装置,反应的化学方程式为MnO2 +4HCl(浓) MnCl2 + Cl2↑+2H2O ,还原剂HCl被氧化生成Cl2336ml时,有336ml/22400ml/mol×2=0.030mol还原剂被氧化;(2)B装置可通过观察气泡的多少控制气流速度,浓硫酸可干燥气体,两气体在装置中充分混合;(3)甲烷与氯气的取代反应中最多可以把四个氢原子取代,需四分子的氯气,为了充分反应,氯气应过量,则x的取值范围是≥4;(4)因氯气过量且有毒,需要除去过量的氯气,在D装置中的石棉上均匀附着KI粉末达该目的;(5)E装置是一个防倒吸的装置,吸收氯化氢的同时防止倒吸;(6)根据元素守恒可知黑色小颗粒应为C,反应的化学方程式为CH4+2Cl2→C+4HCl;(7)氯气与甲烷发生取代反应,可生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳、氯化氢,过量的氯气被D装置吸收,氯化氢被E装置吸收,二氯甲烷、三氯甲烷和四氯化碳为液态,留在E装置中,尾气只有没有反应的甲烷和生成的一氯甲烷,有装置中的盐酸与有机物不互溶,可分液分离。
MnCl2 + Cl2↑+2H2O ,还原剂HCl被氧化生成Cl2336ml时,有336ml/22400ml/mol×2=0.030mol还原剂被氧化;(2)B装置可通过观察气泡的多少控制气流速度,浓硫酸可干燥气体,两气体在装置中充分混合;(3)甲烷与氯气的取代反应中最多可以把四个氢原子取代,需四分子的氯气,为了充分反应,氯气应过量,则x的取值范围是≥4;(4)因氯气过量且有毒,需要除去过量的氯气,在D装置中的石棉上均匀附着KI粉末达该目的;(5)E装置是一个防倒吸的装置,吸收氯化氢的同时防止倒吸;(6)根据元素守恒可知黑色小颗粒应为C,反应的化学方程式为CH4+2Cl2→C+4HCl;(7)氯气与甲烷发生取代反应,可生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳、氯化氢,过量的氯气被D装置吸收,氯化氢被E装置吸收,二氯甲烷、三氯甲烷和四氯化碳为液态,留在E装置中,尾气只有没有反应的甲烷和生成的一氯甲烷,有装置中的盐酸与有机物不互溶,可分液分离。
考点:氯气的实验室制法、甲烷的取代反应、化学实验基础


科目:高中化学 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:选择题
在一定条件下发生反应:2A(g)+2B(g)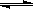 xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.6molC,又测得反应速率V(D)=0.2mol·L-1·min-1,下列说法正确的是
xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.6molC,又测得反应速率V(D)=0.2mol·L-1·min-1,下列说法正确的是
A.A和B的转化率均是20%
B.x = 4
C.平衡时A的物质的量为2.8mol
D.平衡时气体压强比原来减小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市宝坻区四校高二11月联考化学试卷(解析版) 题型:填空题
(7分)化学反应2A(g) B(g)+D(g)在四种不同条件下进行,B、D的起始浓度为0。反应物A的浓度(mol·L-1)随时间(min)的变化情况如下表:
实验序号 | 温度 | 0 min | 10 min | 20 min | 30min | 40min | 50 min | 60min |
1 | 800℃ | 1.0 | 0.8 | 0.67 | 0.57 | 0.5 | 0.5 | 0.5 |
2 | 800℃ | c2 | 0.6 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.6 | 0.6 | 0.6 |
4 | 820℃ | 1.0 | 0.4 | 0.25 | 02 | 0.2 | 02 | 02 |
根据上述数据,完成下列填空:
(1)在实验1中,反应在10min至20min时间内v(A)的平均速率为 mol·L-1·min-l
(2)在实验2中A的初始浓度为 mol·L-1,由实验2的数据,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为v3,实验1的反应速率为vl,则v3 (填“>”、“<”或“=”) vl 。且c3 (填“>”、“<”或“=”)1.0 mol·L-1。
(4)比较实验4和实验1,可推测该反应是 (填“吸热”或“放热”)反应,
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市宝坻区四校高二11月联考化学试卷(解析版) 题型:选择题
用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为V1和V2,则V1和V2的关系正确的是
A.V1>V2 B.V1<V2 C.V1=V2 D.V1≤V2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市宝坻区四校高二11月联考化学试卷(解析版) 题型:选择题
在一定温度下,反应A2(气)+B2(气) 2AB(气)达到平衡的标志是
2AB(气)达到平衡的标志是
A.单位时间生成n mol的A2同时生成n mol的AB
B.容器内的总压强不随时间变化
C.单位时间生成2n mol的AB同时生成n mol的B2
D.单位时间生成n mol的A2同时生成n mol的B2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高二上期期中化学试卷(解析版) 题型:选择题
用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是
A.SO2、CS2、HI都是直线型分子
B.BF3键角为120°,SnBr2键角大于120°
C.COCl2、BF3、SO3都是平面三角型分子
D.PCl3、NH3、PCl5都是三角锥型分子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高二上期期中化学试卷(解析版) 题型:选择题
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是

A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏育才中学高二上学期期中化学试卷(解析版) 题型:填空题
(4分)有浓度为0.1 mol?L-1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+) 依次为a mol?L-1,b mol?L-1,c mol?L-1,大小顺序为______。
(2)等体积的以上三种酸分别与过量的NaOH 溶液反应,生成的盐的物质的量依次为n1 mol,n2 mol,n3 mol,它们的大小关系为____________。
(3)中和等量NaOH溶液都生成正盐时,分别需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为___________________________________________。
(4)与等量锌反应时产生氢(气)的速率分别为v1、v2、v3,其大小关系为________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏省高二上学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.CHCl3是正四面体形
B.H2O分子中氧原子为sp2杂化,其分子几何构型为V形
C.二氧化碳中碳原子为sp杂化,为直线形分子
D.NH是三角锥形
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com