
(12分) 海水中富含镁,可经过加碱沉淀、过滤、酸溶、结晶及脱水等步骤得到无水氯化镁,最后电解得到金属镁。
(1)加碱沉淀镁离子时,生成的Mg(OH)2在分散系中处于沉淀溶解平衡,其溶度积常数表达式Ksp= 。
(2)MgCl2溶液显酸性,其水解的离子方程式为 。
(3)除去MgCl2酸性溶液中少量的FeCl3,可加入的试剂有 。
a.MgO b.Mg(OH)2 c.MgCO3 d.MgSO4
(4)若在空气中加热MgCl2·6H2O,可生成Mg(OH)Cl或MgO,写出相关的化学方程式之一 。
(5)MgCl2·6H2O在干燥的HCl气流中加热可得到无水氯化镁,其原因是 。
(6)电解熔融的MgCl2,阳极的电极反应式为: 。
(12分) (每空2分)
(1)Ksp=c(Mg2+)·c2(OH-) (2)Mg2+ + 2H2O  Mg(OH)2 +2H+ (3)abc
Mg(OH)2 +2H+ (3)abc
(4)MgCl2·6H2O Mg(OH)Cl+HCl↑+5H2O↑或MgCl2·6H2O
Mg(OH)Cl+HCl↑+5H2O↑或MgCl2·6H2O MgO + 2HCl↑+5H2O↑
MgO + 2HCl↑+5H2O↑
(5)HCl气流可抑制Mg2+水解 (6)2Cl――2e-=Cl2↑
【解析】
试题分析:(1)根据沉淀溶解平衡的书写可知Mg(OH)2 的溶度积常数表达式Ksp= c(Mg2+)·c2(OH-);
(2)氯化镁属于强酸弱碱盐,Mg2+水解显酸性,其水解的离子方程式为Mg2++2H2O Mg(OH)2 +2H+;
Mg(OH)2 +2H+;
(3)根据Fe3++3H2O Fe(OH)3 +3H+,加入能消耗H+的物质,导致平衡正向移动,Fe3+生成沉淀除去,该除杂过程不能引入杂质离子,所以符合条件的有a.MgO、b.Mg(OH)2 和c.MgCO3 ;
Fe(OH)3 +3H+,加入能消耗H+的物质,导致平衡正向移动,Fe3+生成沉淀除去,该除杂过程不能引入杂质离子,所以符合条件的有a.MgO、b.Mg(OH)2 和c.MgCO3 ;
(4)由于MgCl2 水解产生HCl,HCl易挥发,导致氯化镁的水解平衡右移,所以若在空气中加热MgCl2·6H2O,可生成Mg(OH)Cl或MgO,相关的化学方程式为MgCl2·6H2O Mg(OH)Cl+HCl↑+5H2O↑或MgCl2·6H2O
Mg(OH)Cl+HCl↑+5H2O↑或MgCl2·6H2O MgO + 2HCl↑+5H2O↑;
MgO + 2HCl↑+5H2O↑;
(5)根据MgCl2 +2H2O Mg(OH)2 +2HCl, HCl气流可抑制Mg2+水解;
Mg(OH)2 +2HCl, HCl气流可抑制Mg2+水解;
(6)电解熔融的MgCl2,阴离子在阳极放电,阳极的电极反应式为2Cl――2e-=Cl2↑。
考点:考查沉淀溶解平衡,物质的除杂,盐类的水解,电极反应式的书写等知识。


科目:高中化学 来源:2014-2015四川省攀枝花市高二上学期期末考试化学试卷(解析版) 题型:填空题
(8分)孔雀石的主要成分为Cu2(OH)2CO3,还含少量铁的氧化物和硅的氧化物。以下是实验室以孔雀石为原料制备CuSO4·5H2O晶体的流程图:
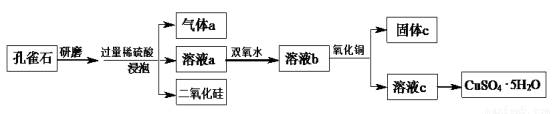
请回答下列问题:
(1)研磨孔雀石的目的是 。
(2)加入双氧水的目的是将溶液中的Fe2+转化为Fe3+,相应的离子方程式为 。
(3)固体c中主要成分的化学式为 。加入氧化铜的作用是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省乐山市高一年级上学期期末考试化学试卷(解析版) 题型:选择题
0.8 g某物质含有3.01×1022个分子,该物质的相对分子质量约为
A.8 B.16 C.64 D.160
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省吉安市高一上学期期末考试化学试卷(解析版) 题型:选择题
HO2(超氧酸)是一种弱酸,具有极高的活性。一定条件下,铜与盐酸、氧气发生如下反应可生成 ,下列说法正确的是
,下列说法正确的是
A.上述反应中,O2发生了氧化反应
B.HO2在碱溶液中能稳定存在
C.上述反应中HO2是还原产物
D.上述反应的离子方程式为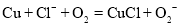
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省吉安市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列操作中,溶液的颜色不发生变化的是
A.氧化镁固体加入稀盐酸中,完全溶解
B.氢氧化铜加入到稀硫酸中
C.氯化铁溶液中加入足量铜粉,充分振荡
D.氯化铁溶液中滴加硫氰化钾(KSCN)溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:选择题
在2L的密闭容器中,起始时均投入2molCO,在不同条件下发生反应:CO(g) +2H2(g)  CH3OH(g) △H <0。有关信息如图所示,下列说法正确的是
CH3OH(g) △H <0。有关信息如图所示,下列说法正确的是

A.T1<T2
B.同一温度下,n(H2)/n(CO)越大,平衡常数也越大
C.T1℃时该反应的平衡常数为4.0
D.相同条件下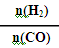 越大,CO和H2的转化率也越大
越大,CO和H2的转化率也越大
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.铅蓄电池放电时的负极和充电时的阳极均发生还原反应
B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
D.纯碱溶于热水中去污效果增强,说明纯碱的水解是放热反应
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省泰州市姜堰区高一上学期期末化学试卷(解析版) 题型:选择题
日常生活和工业生产中遇到的很多问题都涉及到化学知识,下列说法正确的是
A.节日绽放的焰火运用到“焰色反应”原理
B.处理废水时加入明矾作为消毒剂可以除去水中的细菌
C.纯碱可用作制药工业的原料,用于治疗胃酸过多
D.光导纤维的主要成分为高纯度的硅单质,光导纤维遇强碱会“断路”
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市四校高三3月联合考试理综化学试卷(解析版) 题型:填空题
(16分)已知A、B、C、D是原子序数依次增大的四种短周期元素,B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。
请回答下列问题(用元素符号或化学式表示):
(1)元素B、C、D的基态原子的第一电离能由大到小的顺序为 。
(2)M分子中B原子轨道的杂化类型为 。
(3)E+的核外电子排布式为 ,下图是由D、E形成的某种化合物的晶胞结构示意图,该晶体1个晶胞中阳离子的个数为 。

(4)化合物CA3的沸点比化合物BA4的高,其主要原因是 。
(5)写出与BD2互为等电子体的C3-的结构式 。
(6)微生物燃料电池是一种利用微生物将有机物中的化学能直接转化成电能的装置.最早用于有机废水处理,下图是利用微生物燃料电池处理含M废水的装置,其中3是质子交换膜.负极所在的左室中发生反应的电极反应式是 。

(7)铁粉和E单质粉末的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(假设硝酸的还原产物只有NO).则稀硝酸的浓度为 mol/L。
编号 | ① | ② | ③ | ④ |
稀硝酸的体积/mL | 100 | 200 | 300 | 400 |
剩余金属的质量/g | 18.0 | 9.6 | 0 | 0 |
NO的体积/mL | 2240 | 4480 | 6720 | V |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com