
| ||
| ||
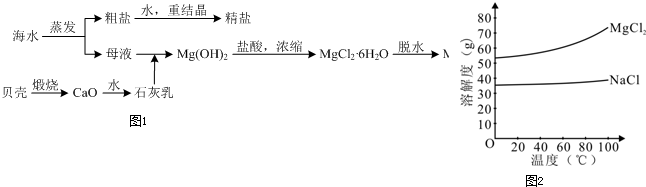
| (203-40a-95b)g��36.5% |
| 36.5g/mol |
|
| 108 |
| 145 |
| 37 |
| 145 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A | B | C | |
| ���� | 3��0.1mol/LH2SO4��Һ | 1mL1.5mol/LNa2CO3��Һ | 2mL1mol/LBa��OH��2��Һ |
| ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� | �� | �� | ||
| ��ʼ���ʵ��� | n��SO2��/mol | 0.4 | 0.8 | 0.8 |
| n��O2��/mol | 0.24 | 0.24 | 0.48 | |
| SO2��ƽ��ת����/% | 80 | ��1 | ��2 | |
| A�����з�Ӧ��ƽ�ⳣ��С���� |
| B�����¶��£�ƽ�ⳣ��ֵΪ400 |
| C��ƽ��ʱ������c��SO3���Ǽ��е�2�� |
| D��ƽ��ʱ������O2��ת���ʴ�������O2��ת���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��+1 | B��+2 | C��+3 | D��+4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2Na+2H2O=H2��+2NaOH |
| B��Cl2+NaOH=NaCl+NaClO+H2O |
| C��SO2+Cl2+2H2O=2HCl+H2SO4 |
| D��2F2+2H2O=4HF+O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CHCl3������������ |
| B��H2O��������ԭ��Ϊsp2�ӻ�������Ӽ��ι���ΪV�� |
| C��������̼��̼ԭ��Ϊsp�ӻ���Ϊֱ���η��� |
| D��NH4+�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���٢� | B���ڢ� | C���٢� | D���ڢ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com