
在标准状况下,等质量的CH4 和CO2比较,下列说法中正确的是
A.密度比4:11 B.分子数之比为4:11
C.体积比4:11 D.物质的量之比为4:11
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 向饱和CaCl2溶液中通入少量的CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 向碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| C. | 向Cu粉中加入过量的浓HNO3:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 氯化铵溶液显酸性的原因:NH4++OH-=NH3•H2O+H+ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
下列关于离子的检验及结论一定正确的是
A.加入稀盐酸有气体生成,将气体通入澄清石灰水中溶液变浑浊,则溶液中一定有CO32-
B.加入BaCl2溶液有白色沉淀生成,再加盐酸,沉淀不消失,则溶液中一定有SO42-
C.加入浓氢氧化钠溶液并加热,生成的气体能使湿润的红色石蕊试纸变蓝,则溶液中一定含有NH4+
D.加入碳酸钠溶液生成白色沉淀,再加盐酸白色沉淀消失,则溶液中一定含有Ba2+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
NA表示阿伏加德罗常数,下列叙述正确的是
A.12gC-13含有的原子数为NA
B.28gCO和44gCO2含有的氧原子数均为NA
C.1.7gH2O2中含有的电子数为0.9NA
D.标准状况下,2.24LH2O所含分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
下列电离方程式错误的是
A.CaCl2 = Ca2++2Cl- B.Na2SO4=2Na+ +SO42-
C.HNO3=H++NO3- D.KClO3=K++C1-+3O2-
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式为: | |
| B. | S2-的离子离子结构示意图是: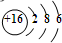 | |
| C. | 原子核内有18个中子的氯原子:3518Cl | |
| D. | HBr电子式为: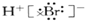 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com