
【题目】研究表明,利用FeCl2、NH4H2PO4、Li2CO3和苯胺(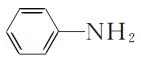 )制备的磷酸亚铁锂(LiFePO4)可用作电池的正极材料。
)制备的磷酸亚铁锂(LiFePO4)可用作电池的正极材料。
(1)Fe2+基态核外电子排布式为________。
(2) N、P、O三种元素的电负性由大到小的顺序为________。
(3) CO32-中心原子轨道的杂化类型为________;与CO32-互为等电子体的一种分子为________(填化学式)。
(4) 1 mol苯胺分子中含有σ键的数目为________;苯胺与甲苯的相对分子质量相近,但苯胺的沸点高于甲苯,其原因是________________________________。
【答案】[Ar]3d6或1s22s22p63s23p63d6 O>N>P sp2 SO3 14 mol 苯胺分子间可形成氢键
【解析】
(1)铁是26号元素,其基态电子排布式为:1s22s22p63s23p63d64s2,失去2个电子变成亚铁离子Fe2+,Fe2+基态核外电子排布式为[Ar]3d6或1s22s22p63s23p63d6;
(2)同周期从左到右、同主族从下到上,电负性逐渐增大,根据元素在元素周期表中的位置,可知N、P、O三种元素的电负性由大到小的顺序为:O>N>P;
(3)CO32-中心原子碳原子孤对电子对数=![]() =0,杂化轨道数目=3+0=3,碳原子采取sp2杂化;CO32-的原子数为4,价电子数为24,等电子体是指具有相同原子数和相同价电子数的分子或原子团,根据等电子体的定义可知,与CO32-互为等电子体的分子有SO3、BF3等,答案为:sp2;SO3;
=0,杂化轨道数目=3+0=3,碳原子采取sp2杂化;CO32-的原子数为4,价电子数为24,等电子体是指具有相同原子数和相同价电子数的分子或原子团,根据等电子体的定义可知,与CO32-互为等电子体的分子有SO3、BF3等,答案为:sp2;SO3;
(4)苯胺( )中C-C键、C-H键、C-N键、N-H键均为σ键,1 mol苯胺分子中含有σ键的数目共计为14mol;苯胺为分子晶体,由分子构成,苯胺与甲苯的相对分子质量相近,但苯胺的沸点(184.4℃)高于甲苯的沸点(110.6℃),原因是苯胺分子之间存在氢键,答案为:14mol;苯胺分子间可形成氢键。
)中C-C键、C-H键、C-N键、N-H键均为σ键,1 mol苯胺分子中含有σ键的数目共计为14mol;苯胺为分子晶体,由分子构成,苯胺与甲苯的相对分子质量相近,但苯胺的沸点(184.4℃)高于甲苯的沸点(110.6℃),原因是苯胺分子之间存在氢键,答案为:14mol;苯胺分子间可形成氢键。


科目:高中化学 来源: 题型:
【题目】安全是顺利进行实验及避免伤害的保障.下列实验操作正确且不是从实验安全角度考虑的是( )

A. 操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B. 操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C. 操作③:吸收氨气或氯化氢气体并防止倒吸
D. 操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3与NaHCO3的性质判断正确的是( )
A.常温下溶解度:Na2CO3<NaHCO3
B.热稳定性:Na2CO3<NaHCO3
C.与同浓度同体积的盐酸反应的速率:Na2CO3>NaHCO3
D.与澄清石灰水反应,均有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同质量的镁和铝分别与足量盐酸反应产生的氢气体积比是___;相同体积的镁和铝分别与足量盐酸反应产生的氢气较多的是___;相同物质的量的镁和铝分别与足量盐酸反应产生的氢气体积比是___。(镁的密度:1.738g/cm3,铝的密度:2.70g/cm3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图①②③④表示由不同化学元素组成的化合物,以下说法正确的是
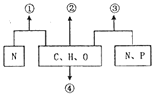
A. 若①为某生物大分子的组成单位,则①最可能是核苷酸
B. 若②是细胞中的储能物质,则②一定是脂肪
C. 若③是病毒的遗传物质,则③一定是RNA
D. 若④是植物细胞壁的主要成分,则④可能是纤维素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】矿业废水中Al3+含量的测定和处理是环境保护的重要课题。
(1)向矿业废水中加入NaOH溶液至沉淀不再溶解,再加入一定量的NaHCO3溶液搅拌,反应生成丝钠铝石[NaAl(OH)2CO3]沉淀,过滤除去。写出加入NaHCO3溶液生成丝钠铝石沉淀的离子方程式:____________________________________。
(2) 为确定加入NaHCO3溶液的量,需测定矿业废水中Al3+的含量。工业上常采用EDTA络合滴定法,步骤如下:
步骤1:CuSO4标准液的配制与标定。取一定量胆矾溶于水,加入适量稀H2SO4,转移到1 L容量瓶中定容。准确量取25.00 mL所配溶液置于250 mL锥形瓶中,用0.005 0 mol·L-1EDTA标准液滴定至终点。重复3次实验,平均消耗EDTA标准液10.00 mL 。
步骤2:样品分析。取10.00 mL矿业废水置于250 mL锥形瓶中,加入一定体积柠檬酸,煮沸;再加入0.005 0 mol·L-1的EDTA标准液20.00 mL,调节溶液pH至4.0,加热;冷却后用CuSO4标准液滴定至终点,消耗CuSO4标准液30.00 mL。(已知:Cu2+、Al3+与EDTA反应的化学计量比均为1∶1)
步骤1中,重复3次实验的目的是____________________________。
② Fe3+也可与EDTA反应,步骤2中加入的柠檬酸是作为掩蔽剂,消除Fe3+的干扰。若该矿业废水样品中含有Fe3+,而上述实验中未加入柠檬酸,则测定的Al3+含量将________(填“偏大”“偏小”或“无影响”)。
③计算该矿业废水中Al3+的含量____________(用mg·L-1表示)(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命法写出下列物质名称或结构简式
(1)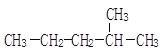 __________;
__________;
(2) ____________;
____________;
(3)![]() ___________;
___________;
(4)![]() ____________;
____________;
(5)2,6-二甲基-4-乙基辛烷_______;
(6)2-甲基-1-戊烯____________;
(7)3-甲基-1-丁炔:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼铁的原理为:Fe2O3 +3CO![]() 2Fe+ 3CO2。
2Fe+ 3CO2。
(1)该反应中氧化剂是__(填化学式),碳元素被__(填“氧化”或“还原”)。
(2)若消耗了3molCO,则生成CO2的体积是__L(标准状况),转移电子的物质的量是___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的标准燃烧热分别为-393.5 kJ/mol、-285.8 kJ/mol、-870.3 kJ/mol,则1/2CH3COOH(l) ═ C(s)+H2(g)+1/2O2(g)的反应热为( )
A. +244.15 kJ/molB. +488.3 kJ/molC. -191 kJ/molD. +191 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com