
分析 (1)在25℃时,在0.01mol/L HCl溶液中,c(H+)=c(HCl)=0.01mol/L,根据pH=-lgc(H+)计算即可;碱溶液中先计算氢氧根离子浓度,再根据氢离子浓度与氢氧根离子浓度和离子积常数之间的关系式计算;
(2)若所得混合溶液呈中性,aL×0.1mol/L=bL×0.001mol/L;若所得混合溶液pH=12,则碱过量,所以$\frac{0.1a-0.001b}{a+b}$=0.01mol/L.
解答 解:(1)在25℃时,在0.1mol/L HCl溶液中,c(H+)=c(HCl)=0.1mol/L,pH=-lgc(H+)=-lg0.1mol/L=1;0.005mol/LBa(OH)2溶液中氢氧根离子浓度=0.005 mol/L×2=0.01mol/L,根据离子积常数KW=c(H+)•c(OH-),知,溶液中氢离子浓度c(H+)=$\frac{1{0}^{-14}}{0.01}$mol/L=10-12mol/L,所以溶液的pH=12,
故答案为:1;12;
(2)①若所得混合溶液呈中性,aL×0.1mol/L=bL×0.001mol/L,解得a:b=1:100;故答案为:1:100;
②若所得混合溶液pH=12,则碱过量,所以$\frac{0.1a-0.001b}{a+b}$=0.01mol/L,解得a:b=11:90,故答案为:11:90.
点评 本题考查酸碱混合pH的计算,明确浓度与pH的换算、酸碱混合溶液为中性、碱性时离子浓度的关系等是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
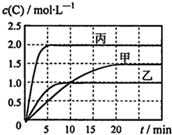 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+хB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中物质C的浓度随时间变化关系分别用表和图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+хB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中物质C的浓度随时间变化关系分别用表和图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T3 |
| 反应物起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
| A. | 达平衡时A(g)的浓度:乙=丙>甲 | |
| B. | 甲容器中达平衡时B(g)的转化率为75% | |
| C. | 温度分别为T1、T2时,该反应的平衡常数:K(T1)<K(T2) | |
| D. | 丙容器中达到平衡后,若同时向容器中再充入1mol A(g)、1mol B(g)、1molC(g),则平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:2CrO42-+2H+?Cr2O72-+H2O.25℃时,调节初始浓度为1.0mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线.下列说法不正确的是( )
已知:2CrO42-+2H+?Cr2O72-+H2O.25℃时,调节初始浓度为1.0mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线.下列说法不正确的是( )| A. | 平衡时,pH越小,c(Cr2O72-)越大 | |
| B. | A点CrO42-的平衡转化率为50% | |
| C. | A点CrO42-转化为Cr2O72-反应的平衡常数K=1014 | |
| D. | 平衡时,若溶液中c(Cr2O72-)=c(Cr2O42-),则c(H+)>2.0×10-7 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO是还原剂 | B. | Fe2O3被还原 | ||
| C. | 属于氧化还原反应 | D. | 属于置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和10 mL 0.1mol•L-1 醋酸与中和100 mL 0.01mol•L-1 的醋酸所需同种碱溶液的用量不同 | |
| B. | 两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1=10c2 | |
| C. | 常温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| D. | 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
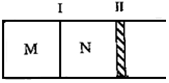 如图所示隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.初始M、N容积相同,保持温度不变,向M、N中分别通入x mol A和y mol B的混合气体.下列说法不正确的是( )
如图所示隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.初始M、N容积相同,保持温度不变,向M、N中分别通入x mol A和y mol B的混合气体.下列说法不正确的是( )| A. | 若平衡时A气体在两容器中的体积分数相等,则x一定等于y | |
| B. | 若x:y=1:2,则平衡时,M中的转化率:A<B | |
| C. | 若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90% | |
| D. | 若x=1.4,y=1,N中达到平衡时体积为2L,C为0.4mol,则反应起始时M的体积为2.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com