
| 物质 | Al | Fe |
| 熔点(℃) | 660 | 1535 |
| 沸点(℃) | 2467 | 2750 |
| 所用试剂 | |
| 实验操作及现象 | |
| 有关反应的化学方程式 |
| 所用试剂 | NaOH溶液 |
| 实验操作及现象 | 取少许熔融物,滴加氢氧化钠溶液,振荡,有气泡产生,证明熔融物中有金属铝 |
| 有关反应的化学方程式 | 2Al+2NaOH+2H2O→2NaAlO2+3H2↑ |


科目:高中化学 来源: 题型:
 A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子的原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子的原子核内质子数和中子数相等.查看答案和解析>>
科目:高中化学 来源: 题型:
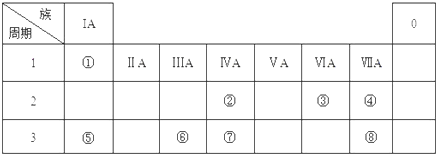
查看答案和解析>>
科目:高中化学 来源: 题型:
| H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
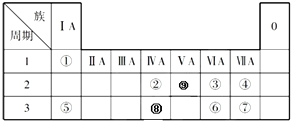
查看答案和解析>>
科目:高中化学 来源: 题型:

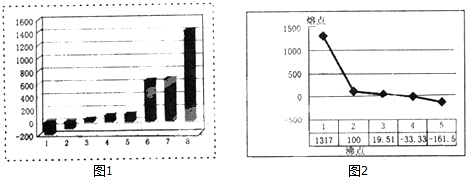
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20mL 2mol/L Mg(NO3)2 |
| B、100mL 2.5mol/L NaNO3 |
| C、25mL 1.0mol/L Al(NO3)3 |
| D、30mL 2.5mol/L NH4NO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、互为同系物的有机物其组成元素相同,且结构必须相似 |
| B、分子组成相差一个或若干个CH2原子团的化合物一定互为同系物 |
| C、分子式为C3H6与C6H12的两种有机物一定互为同系物 |
| D、互为同系物的有机物其相对分子质量数值一定相差14n(n为正整数) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com