
【题目】研究![]() 氧化
氧化![]() 制
制![]() 对资源综合利用有重要意义。相关的主要化学反应有:
对资源综合利用有重要意义。相关的主要化学反应有:
Ⅰ ![]()
![]()
Ⅱ ![]()
![]()
Ⅲ ![]()
![]()
Ⅳ ![]()
![]()
已知:![]() 时,相关物质的相对能量(如图1)。
时,相关物质的相对能量(如图1)。

可根据相关物质的相对能量计算反应或变化的![]() (
(![]() 随温度变化可忽略)。例如:
随温度变化可忽略)。例如: ![]()
![]() 。
。
请回答:
(1)①根据相关物质的相对能量计算![]() _____
_____![]() 。
。
②下列描述正确的是_____
A 升高温度反应Ⅰ的平衡常数增大
B 加压有利于反应Ⅰ、Ⅱ的平衡正向移动
C 反应Ⅲ有助于乙烷脱氢,有利于乙烯生成
D 恒温恒压下通水蒸气,反应Ⅳ的平衡逆向移动
③有研究表明,在催化剂存在下,反应Ⅱ分两步进行,过程如下:![]()
![]()
![]() ,且第二步速率较慢(反应活化能为
,且第二步速率较慢(反应活化能为![]() )。根据相关物质的相对能量,画出反应Ⅱ分两步进行的“能量-反应过程图”,起点从
)。根据相关物质的相对能量,画出反应Ⅱ分两步进行的“能量-反应过程图”,起点从![]() 的能量
的能量![]() ,开始(如图2)_____
,开始(如图2)_____
。

(2)①![]() 和
和![]() 按物质的量1:1投料,在
按物质的量1:1投料,在![]() 和保持总压恒定的条件下,研究催化剂X对“
和保持总压恒定的条件下,研究催化剂X对“![]() 氧化
氧化![]() 制
制![]() ”的影响,所得实验数据如下表:
”的影响,所得实验数据如下表:
催化剂 | 转化率 | 转化率 | 产率 |
催化剂X | 19.0 | 37.6 | 3.3 |
结合具体反应分析,在催化剂X作用下,![]() 氧化
氧化![]() 的主要产物是______,判断依据是_______。
的主要产物是______,判断依据是_______。
②采用选择性膜技术(可选择性地让某气体通过而离开体系)可提高![]() 的选择性(生成
的选择性(生成![]() 的物质的量与消耗
的物质的量与消耗![]() 的物质的量之比)。在
的物质的量之比)。在![]() ,乙烷平衡转化率为
,乙烷平衡转化率为![]() ,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到
,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到![]() 。结合具体反应说明乙烷转化率增大的原因是_____。
。结合具体反应说明乙烷转化率增大的原因是_____。
【答案】430 AD 
![]()
![]() 的产率低,说明催化剂X有利于提高反应Ⅲ速率 选择性膜吸附
的产率低,说明催化剂X有利于提高反应Ⅲ速率 选择性膜吸附![]() ,促进反应Ⅱ平衡正向移动
,促进反应Ⅱ平衡正向移动
【解析】
根据题中信息用相对能量求反应热;根据平衡移动原理分析温度、压强和反应物的浓度对化学平衡的影响,并作出相关的判断;根据相关物质的相对能量和活化能算出中间产物、过渡态和最终产物的相对能量,找到画图的关键数据;催化剂的选择性表现在对不同反应的选择性不同;选择性膜是通过吸附目标产品而提高目标产物的选择性的,与催化剂的选择性有所区别。
(1)①由图1的数据可知,C2H6(g)、CO2(g)、CO(g)、H2(g)的相对能量分别为-84kJmol-1、-393 kJmol-1、-110 kJmol-1、0 kJmol-1。由题中信息可知,H=生成物的相对能量-反应物的相对能量,因此,C2H6(g)+2CO2(g)4CO(g)+3H2(g) H3=(-110 kJmol-1)4-(-84kJmol-1)-( -393 kJmol-1)2=430 kJmol-1。
②A.反应Ⅰ为吸热反应,升高温度能使其化学平衡向正反应方向移动,故其平衡常数增大,A正确;
B.反应Ⅰ和反应Ⅱ的正反应均为气体分子数增大的反应,增大压强,其化学平衡均向逆反应方向移动,B不正确;
C.反应Ⅲ的产物中有CO,增大CO的浓度,能使反应Ⅱ的化学平衡向逆反应方向移动,故其不利于乙烷脱氢,不利于乙烯的生成,C不正确;
D.反应Ⅳ的反应前后气体分子数不变,在恒温恒压下向平衡体系中通入水蒸气,体系的总体积变大,水蒸气的浓度变大,其他组分的浓度均减小相同的倍数,因此该反应的浓度商变大(大于平衡常数),化学平衡向逆反应方向移动,D正确。
综上所述,描述正确的是AD。
③由题中信息可知,反应Ⅱ分两步进行,第一步的反应是C2H6(g)+CO2(g)C2H4(g)+H2(g) +CO2(g),C2H4(g)、H2(g)、CO2(g)的相对能量之和为52 kJmol-1+0+(-393 kJmol-1)= -341 kJmol-1;第二步的反应是C2H4(g)+H2(g) +CO2(g)C2H4(g)+H2O(g) +CO(g),其活化能为210 kJmol-1,故该反应体系的过渡态的相对能量又升高了210 kJmol-1,过渡态的的相对能量变为-341 kJmol-1+210 kJmol-1= -131 kJmol-1,最终生成物C2H4(g)、H2O(g)、CO(g)的相对能量之和为(52 kJmol-1)+(-242 kJmol-1)+(-110 kJmol-1)= -300 kJmol-1。根据题中信息,第一步的活化能较小,第二步的活化能较大,故反应Ⅱ分两步进行的“能量—反应过程图”可以表示如下: 。
。
(2)①由题中信息及表中数据可知,尽管CO2和C2H6按物质的量之比1:1投料,但是C2H4的产率远远小于C2H6的转化率,但是CO2的转化率高于C2H6,说明在催化剂X的作用下,除了发生反应Ⅱ,还发生了反应Ⅲ,而且反应物主要发生了反应Ⅲ,这也说明催化剂X有利于提高反应Ⅲ速率,因此,CO2氧化C2H6的主要产物是CO。故答案为:CO;C2H4的产率低说明催化剂X有利于提高反应Ⅲ速率。
②由题中信息可知,选择性膜技术可提高C2H4的选择性,由反应ⅡC2H6(g)+CO2(g)C2H4(g)+H2O(g) +CO(g)可知,该选择性应具体表现在选择性膜可选择性地让C2H4通过而离开体系,即通过吸附C2H4减小其在平衡体系的浓度,从而促进化学平衡向正反应方向移动,因而可以乙烷的转化率。故答案为:选择性膜吸附C2H4,促进反应Ⅱ平衡向正反应方向移动。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:(CH3)2NNH2(l)+2N2O4(l)====2CO2(g)+3N2(g)+4H2O(g)(Ⅰ)
(1)反应(Ⅰ)中氧化剂是_____________________________。
(2)火箭残骸中常出现红棕色气体,原因为:N2O4(g) ![]() 2NO2(g)(Ⅱ)当温度升高时,气体颜色变深,则反应(Ⅱ)为_______(填“吸热”或“放热”)反应。
2NO2(g)(Ⅱ)当温度升高时,气体颜色变深,则反应(Ⅱ)为_______(填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是____________。

若在相同温度下,上述反应改在体积为1 L的恒容密闭容器中进行,平衡常数______(填“增大”“不变”或“减小”),反应3 s后NO2的物质的量为0.6 mol,则0~3 s内的平均反应速率v(N2O4)= ________mol·L-1·s-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解NaB(OH)4溶液制备H3BO3的原理如下图所示,下列叙述错误的是
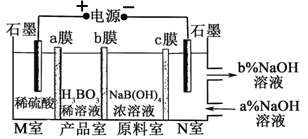
A. M室发生的电极反应式:2H2O-4e-=O2↑+4H+
B. a、c为阴离子交换膜,b为阳离子交换膜
C. N室中:a%<b%
D. 理论上每生成1 mol H3BO3,两极室共产生标准状况下16.8 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是硅酸盐水泥的重要成分之一,其相关性质的说法不正确的是( )
是硅酸盐水泥的重要成分之一,其相关性质的说法不正确的是( )
A. 可发生反应:![]()
B. 具有吸水性,需要密封保存
C. 能与![]() ,反应生成新盐
,反应生成新盐
D. 与足量盐酸作用,所得固体产物主要为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(用元素符号或化学式回答下列问题)
(1)在这些元素中,化学性质最不活泼的是_______,其原子结构示意图是_________。
(2)用电子式表示元素④与⑦组成的化合物的形成过程:________,该化合物属于_______(填“共价”或“离子”)化合物。
(3)常温下呈液态的非金属单质是_______。
(4)表中能形成两性氢氧化物的元素是_________,该元素的单质与⑨的最高价氧化物的水化物反应的化学方程式是___________。
(5)①、⑥、⑦三种元素的最高价氧化物对应的水化物中,按酸性增强的顺序排列为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇广泛存在于食物(例如桑甚、花生,尤其是葡萄)中,它可能具有抗癌性。能够与1 mol该化合物发生反应的Br2和H2的最大用量分别是( )

A.1mol、1molB.3.5mol、7mol
C.3.5mol、6molD.6mol、7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种粒子。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是( )

A.该反应的还原剂是Cl-
B.消耗1 mol还原剂,转移3 mol电子
C.氧化剂与还原剂的物质的量之比为2∶3
D.反应后溶液的酸性明显增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,通电5min后,C中Cu电极的质量增加1.08g。假设电解过程中溶液的体积不变。

(1)电源中Y是______极。A池中阳极的电极反应式为______,C池中阴极的电极反应式为______。
(2)通电5min后,如果B槽中共收集到112mL气体(标准状况),且溶液体积1000mL,计算通电前溶液中Cu2+的物质的量浓度______。
(3)如果A池溶液是1000mL食盐水(假设电解液足量),则通电5min后,常温下溶液的pH为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com