
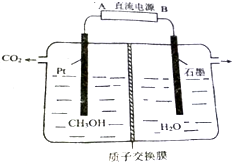
 工业废水中的甲醇也可用电化学方法处理,原理如图所示.
工业废水中的甲醇也可用电化学方法处理,原理如图所示.分析 甲醇发生氧化反应是电解池的阳极,所以A为电源的正极,B为电源的负极,阳极是甲醇发生氧化反应,其电极反应式为H2O+CH3OH-6e-=CO2↑+6H+;而阴极是6H++6e-=3H2↑,两极共收集到4mol气体,质量差为:44-6=38g,由此分析.
解答 解:(1)甲醇发生氧化反应是电解池的阳极,所以A为电源的正极,B为电源的负极,故答案为:负;
(2)阳极是甲醇发生氧化反应,其电极反应式为H2O+CH3OH-6e-=CO2↑+6H+,故答案为:H2O+CH3OH-6e-=CO2↑+6H+;
(3)阳极是甲醇发生氧化反应,其电极反应式为H2O+CH3OH-6e-=CO2↑+6H+;而阴极是6H++6e-=3H2↑,两极共收集到4mol气体,质量差为:44-6=38g,所以收集到标准状况下气体22.4L,质量差为$\frac{38g}{4}$=9.5g,故答案为:9.5.
点评 本题考查电解池原理与有关计算,难度较大,(3)中关键注意观察电极产物,判断发生的反应,注意根据方程式判断左室中质量的变化.


科目:高中化学 来源: 题型:解答题
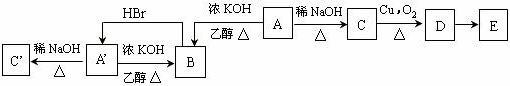
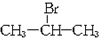 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中:K,CH3OH,Br-,NO3- | |
| B. | 在氨水溶液中:Al3+,NO3-,Cl-,Ag+ | |
| C. | 某透明澄清的溶液中:NH4+,Fe3+,NO3-,Cl- | |
| D. | 能使甲基橙显红色的溶液:K+,Cr2O72-,CH2CH2OH,SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  如图所示装置完成实验室制氨气 | |
| B. |  如图所示装置蒸发FeCl3溶液制备无水FeCl3 | |
| C. | 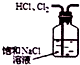 如图所示装置除去HCl中含有的少量Cl2 | |
| D. |  如图所示装置可用于分离二氧化锰和二氯化锰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的H2C2O4溶液中,c(H+)=c(HC2O4-)=10-4mol/L | |
| B. | pH=x的CH3COOH溶液100mL,稀释10倍后pH=y,x-y>1 | |
| C. | pH=2的NaHC2O4溶液与pH=12的NaOH溶液以任意比混合,混合液中:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) | |
| D. | pH相同的①CH3COONa、②Na2CO3 、③NaClO三种溶液中c(Na+):①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HO(CH2)2CHO | B. | HO(CH2)2COOH | C. | HOOCCOOH | D. | (CH3)3CCOOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com