
常温下,下列有关醋酸的叙述中不正确的是( )
A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
B.浓度均为0.1 mol·L-1的CH3COOH溶液和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
C.将pH=a的醋酸稀释为pH=a+1的过程中, 不断减小
不断减小
D.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=14
科目:高中化学 来源: 题型:
银铜合金广泛用于航空工业,从切割废料中回收银并制备铜化工产品的工艺如下:
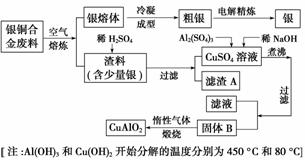
(1)电解精炼银时,阴极反应式为________;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为________________。
(2)固体混合物B的组成为__________;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为____________。
(3)完成煅烧过程中一个反应的化学方程式:____CuO+____Al2O3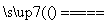 ____CuAlO2+________↑。
____CuAlO2+________↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0 kg废料中的铜可完全转化为________ mol CuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液________ L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是________、过滤、洗涤和干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25 ℃时有关弱酸的电离平衡常数如下表:
| 弱酸化学式 | HX | HY | H2CO3 |
| 电离平衡常数 | 7.8×10-9 | 3.7×10-15 | K1=4.3×10-7 K2=5.6×10-11 |
下列推断正确的是( )
A.HX、HY两种弱酸的酸性:HX>HY
B.相同条件下溶液的碱性:NaX>Na2CO3>NaY>NaHCO3
C.结合H+的能力:CO >Y->X->HCO
>Y->X->HCO
D.HX和HY酸性相同,都比H2CO3弱
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于电解质溶液的叙述正确的是( )
A.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大
B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH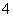 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
C.中和pH与体积均相同的盐酸和醋酸,消耗NaOH的物质的量相同
D.将pH =4的盐酸稀释后,溶液中所有离子的浓度均降低
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组用废铁泥(主要成分为Fe2O3、FeO和少量Fe)制备磁性Fe3O4纳米材料的流程示意图如下:
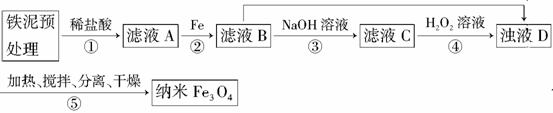
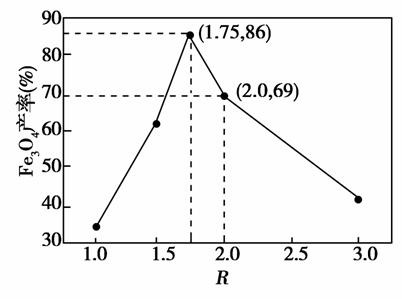
已知:R=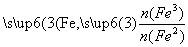 步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。
步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。
(1)步骤②中,主要反应的离子方程式是__________________。
(2)已知:Fe3+在pH=2.8时沉淀完全;Fe2+在pH=6.3时开始沉淀,在pH=8.3时沉淀完全。
步骤③中,用NaOH溶液调pH至9,原因是________________。
(3)浊液D中铁元素以FeOOH形式存在。步骤④中,反应的化学方程式是____________________。
(4)下列说法正确的是________(选填字母)。
a.步骤④中,当反应完成后需再加热一段时间
b.步骤⑤中,反应过程中需要不断补充碱液
c.步骤⑤恰好反应时,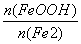 =2:1
=2:1
d.当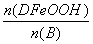 =
=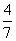 时,Fe3O4的产率最高
时,Fe3O4的产率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
食品抗氧化剂是能阻止或延缓食品氧化变质、提高食品稳定性和延长贮存期的食品添加剂。BHT是一种常用的食品抗氧化剂,合成方法有如下两种:
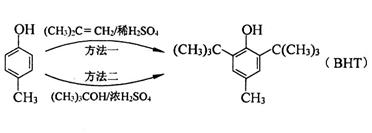
下列说法不正确的是

C.BHT不能与NaHCO3溶液反应生成CO2
D.两种方法的反应类型都是加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D是元素周期表中前三周期里的四种元素,A能与D组成AD2型化合物,AD2中核外电子总数是30。离子D-的核外电子排布与Al3+相同,B和C可以形成BC型化合物,BC分子中质子总数是18,BC水溶液是一种强酸,试回答:
(1) 用电子式表示BC的形成过程:___________________________________;
(2) D单质与水反应的化学方程式是:__________________________________;
(3) 比较AD2中两种微粒的半径:r(A2+)_________r(D-)(填“>”、“<”或“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com