
分析 (1)若盐酸足量,Fe、Al均完全反应,失去电子数之比等于生成氢气的质量比;
(2)若盐酸足量,Fe、Al均完全反应,结合n=$\frac{m}{M}$及失去电子数之比等于生成氢气的质量比计算;
(3)若盐酸足量,Fe、Al均完全反应,结合n=$\frac{m}{M}$及失去电子数之比生成氢气的体积比计算.
解答 解:(1)若盐酸足量,Fe、Al均完全反应,设物质的量均为nmol,则等物质的量的Fe、Al产生H2的质量之比为n×(2-0):n×(3-0)=2:3,故答案为:2:3;
(2)若盐酸足量,Fe、Al均完全反应,设质量均为mg,则等质量的Fe、Al产生H2的质量之比为$\frac{m}{56}$×(2-0):$\frac{m}{27}$×(3-0)=9:28,故答案为:9:28;
(3)若盐酸足量,Fe、Al均完全反应,设质量均为mg,则等质量的Fe、Al产生H2在同温同压下的体积比为$\frac{m}{56}$×(2-0):$\frac{m}{27}$×(3-0)=9:28,故答案为:9:28.
点评 本题考查氧化还原反应的计算,为高频考点,把握酸足量时金属完全反应、电子守恒为解答的关键,侧重分析与计算能力的考查,注意氢气的物质的量比等于质量比也等于体积比,题目难度不大.


科目:高中化学 来源: 题型:填空题
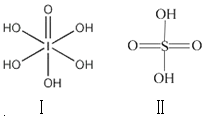 已知硫酸(H2SO4)和高碘酸(H5IO6)的结构分别如图I、II所示:请从结构角度比较二者酸性强弱:H2SO4>H5IO6(填“>”、“<”或“=”).
已知硫酸(H2SO4)和高碘酸(H5IO6)的结构分别如图I、II所示:请从结构角度比较二者酸性强弱:H2SO4>H5IO6(填“>”、“<”或“=”).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
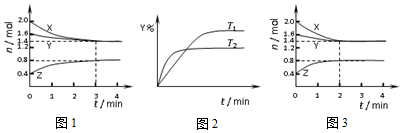
| A. | 容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | |
| B. | 保持其他条件不变,升高温度,平衡向X体积分数增大的方向移动 | |
| C. | 反应进行的前3 min内,用X表示的反应速率 v(X)=0.2mol•(L•min)-1 | |
| D. | 若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用100mL量筒量取8.6mL浓硫酸 | |
| B. | 用托盘天平称量8.75g食盐 | |
| C. | 用500mL的容量瓶来配制需要的450mL溶液 | |
| D. | 用胶头滴管取5mL的某溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
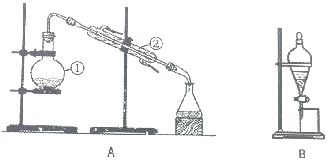 如图装置是实验室中物质分离的常用装置,请回答下列问题.
如图装置是实验室中物质分离的常用装置,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
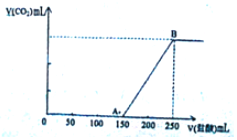 向100mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,向所得溶液中逐滴滴入1mol/L的盐酸溶液,所得气体的体积(标准状态)与所加盐酸的体积关系如图所示
向100mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,向所得溶液中逐滴滴入1mol/L的盐酸溶液,所得气体的体积(标准状态)与所加盐酸的体积关系如图所示查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com