
| A. | ①②③④ | B. | ②③⑤⑥⑦⑧ | C. | ④⑤⑥⑦⑧ | D. | ①②③⑤⑥⑦⑧ |
科目:高中化学 来源: 题型:选择题
| A. | 肯定有SO2、NH3和N2 | B. | 可能有HCl和N2 | ||
| C. | 肯定只有NH3和SO2 | D. | 肯定没有HCl和NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国自主研发制造的国产大型客机C919前不久在上海下线,C919的综合监视电子系统是由无锡企业研发制造.电子监视系统的核心部件是其中的电子芯片.制备该电子芯片的材料是( )
我国自主研发制造的国产大型客机C919前不久在上海下线,C919的综合监视电子系统是由无锡企业研发制造.电子监视系统的核心部件是其中的电子芯片.制备该电子芯片的材料是( )| A. | 铝 | B. | 硅 | C. | 碳 | D. | 钢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业酒精可作为汽车燃料 | B. | 可以和乙酸反应制备香料 | ||
| C. | 75%的酒精可用于医疗消毒 | D. | 工业酒精可用于配制饮料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 检测内容 | 二氧化硫 | 二氧化氮 | PM10 | PM2.5 |
| 指数 | 28 | 24 | 103 | 78 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和甲苯均能使酸性高锰酸钾溶液褪色 | |
| B. | 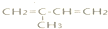 与等物质的量的溴反应产物仅有2种 与等物质的量的溴反应产物仅有2种 | |
| C. | 分子式为C8H10且属于芳香烃的同分异构体有3种 | |
| D. | 等质量的乙烷、乙烯完全燃烧消耗氧气的量前者多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
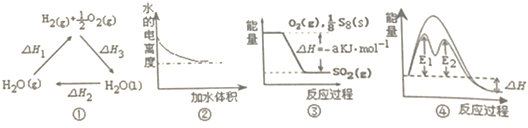
| A. | 图①中△H1=△H2+△H3 | |
| B. | 图②表示0.1mol•L-1氨水加水稀释过程中水的电离度变化曲线 | |
| C. | 图③可知S8燃烧的热化学方程式为S8(s)+8O2(g)=8SO2(g)△H=-8akJ•mol-1 | |
| D. | 图④在催化剂条件下,反应的活化能等于E1+E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液水电离的c(H+)•c(OH-)=10-24 | B. | c(H+)=10-12mol/L的溶液 | ||
| C. | 甲基橙呈黄色的溶液 | D. | 某溶液与Al粉反应产生氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
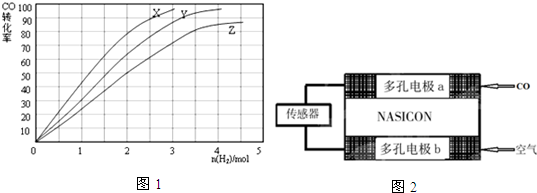
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com