
 2NH3(g);
2NH3(g); ,10min时各物质的浓度不再变化,测得NH3的物质的量为0.4mol。
,10min时各物质的浓度不再变化,测得NH3的物质的量为0.4mol。

 。②平均相对分子质量不变是混合气的质量和混合气的总的物质的量的比值,反应过程中物质的量是变化的,所以当平均相对分子质量不变时,可以说明。同样C也可以说明。B中应是2V正(N2)=V逆(NH3),不正确。平衡时浓度不再发生变化,但氮气和氢气之间的浓度不一定满足1:3,D不正确。平衡时反应速率不是0,E不正确。③0.5molN2、1.5 molH2、1 molNH3就相当于是1molN2、3molH2,所以平衡是等效的,因此氨气的浓度不变,即选项B是正确的。
。②平均相对分子质量不变是混合气的质量和混合气的总的物质的量的比值,反应过程中物质的量是变化的,所以当平均相对分子质量不变时,可以说明。同样C也可以说明。B中应是2V正(N2)=V逆(NH3),不正确。平衡时浓度不再发生变化,但氮气和氢气之间的浓度不一定满足1:3,D不正确。平衡时反应速率不是0,E不正确。③0.5molN2、1.5 molH2、1 molNH3就相当于是1molN2、3molH2,所以平衡是等效的,因此氨气的浓度不变,即选项B是正确的。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
 2NH3。达到平衡后,测得反应放出的热量为18.4kJ,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%。
2NH3。达到平衡后,测得反应放出的热量为18.4kJ,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列正确的是( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列正确的是( )| A.①② | B.④ | C.③ | D.④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 2SO3(g),此时容器中SO3的浓度为0.9mol/L,O2的物质的量为2.1mol,试求:① SO2的转化率;② O2的起始浓度(mol/L);③ SO2的平均反应速率(mol/L· min)
2SO3(g),此时容器中SO3的浓度为0.9mol/L,O2的物质的量为2.1mol,试求:① SO2的转化率;② O2的起始浓度(mol/L);③ SO2的平均反应速率(mol/L· min) 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
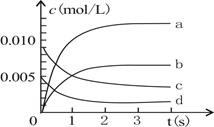
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g)达到平衡的标志是
2Z(g)达到平衡的标志是| A.正反应速率等于逆反应速率,且不等于零 |
| B.X的浓度不再发生变化 |
| C.Y的浓度不再发生变化 |
| D.Z的浓度不再发生变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com