研究CO
2的利用对促进低碳社会的构建具有重要的意义.
(1)已知石墨的标准燃烧热为y kJ?mol
-1,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量.则石墨与氧气反应生成CO的热化学方程式为:
.
(2)高温时,用CO还原MgSO
4可制备高纯MgO.
①750℃时,测得气体中含等物质的量SO
2和SO
3,此时反应的化学方程式是:
.
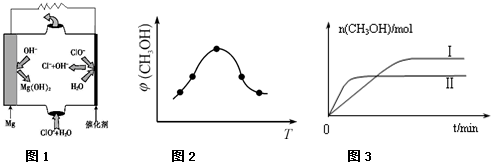
②由MgO可制成“镁-次氯酸盐”燃料电池,其装置示意图如图1所示,该电池反应的离子方程式为:
.
(3)二氧化碳合成甲醇是碳减排的新方向,将CO
2转化为甲醇的热化学方程式为:
CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)△H
①取五份等体积CO
2和H
2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH
3OH)与反应温度T的关系曲线如图2所示,则上述CO
2转化为甲醇反应的△H
(填“>”“<”或“=”)0.
②在两种不同条件下发生反应,测得CH
3OH的物质的量随时间变化如图3所示,曲线I、Ⅱ对应的平衡常数大小关系为K
ⅠK
Ⅱ(填“>”“<”或“=”).
③一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2
3molH2 | a molCO2、b molH2、
c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为
.




 名校课堂系列答案
名校课堂系列答案

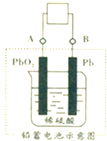 电瓶车所用的电池一般是铅蓄电池,如图是一种典型的可充电电池,电池总反应式为:
电瓶车所用的电池一般是铅蓄电池,如图是一种典型的可充电电池,电池总反应式为: