
【题目】人们运用元素周期律和元素周期表,可以系统研究元素的性质。试回答:
(1)碱金属元素中,锂原子的结构示意图为__、其中6Li、7Li互为__,用电子式表示Li2O的形成过程___。
(2)金属钾19K位于元素周期表中的第__周期、第__族;钾的氧化物有多种,其中过氧化钾(K2O2)和超氧化钾(KO2)常作供氧剂,写出过氧化钾与CO2反应的化学方程式:___;超氧化钾与水反应如下,请配平该反应的化学方程式:
_KO2+_H2O=_KOH+_O2↑+_H2O2
(3)第三周期元素中,酸性最强的HClO4中氯元素的化合价为__、可作半导体材料的元素是__(填名称),当反应H2+Cl2![]() 2HCl发生过程中,涉及到___键断裂和__键的形成。(填:离子键或极性键或非极性键)
2HCl发生过程中,涉及到___键断裂和__键的形成。(填:离子键或极性键或非极性键)
【答案】![]() 同位素
同位素 ![]() 四 ⅠA 2K2O2+2CO2=2K2CO3+O2 2 2 2 1 1 +7 硅 非极性键 极性键
四 ⅠA 2K2O2+2CO2=2K2CO3+O2 2 2 2 1 1 +7 硅 非极性键 极性键
【解析】
(1)碱金属元素中,锂原子为3号元素质子数相同中子数不同的同一元素不同原子互为同位素, Li2O是离子化合物;
(2)金属钾19K为19号元素,质子数为19,原子结构示意图为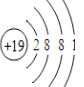 ,过氧化钾与CO2反应生成碳酸钠和氧气;根据氧化还原反应规律配平方程式;
,过氧化钾与CO2反应生成碳酸钠和氧气;根据氧化还原反应规律配平方程式;
(3)根据化合物中化合价为零,判断氯元素的化合价,根据化合物中化学键的类型判断化学键的断裂与形成。
(1)碱金属元素中,锂原子为3号元素,原子结构示意图为![]() ,质子数相同中子数不同的同一元素不同原子互为同位素,则6Li、7Li互为同位素,Li2O是离子化合物,其形成过程
,质子数相同中子数不同的同一元素不同原子互为同位素,则6Li、7Li互为同位素,Li2O是离子化合物,其形成过程![]() ;
;
(2)金属钾19K为19号元素,质子数为19,原子结构示意图为 ,位于元素周期表中的第四周期、第ⅠA族;过氧化钾与CO2反应生成碳酸钠和氧气,化学方程式为:2K2O2+2CO2=2K2CO3+O2;超氧化钾与水反应,根据氧化还原反应电子得失守恒及物料守恒,配平该反应的化学方程式:2KO2+2H2O=2KOH+O2↑+H2O2;
,位于元素周期表中的第四周期、第ⅠA族;过氧化钾与CO2反应生成碳酸钠和氧气,化学方程式为:2K2O2+2CO2=2K2CO3+O2;超氧化钾与水反应,根据氧化还原反应电子得失守恒及物料守恒,配平该反应的化学方程式:2KO2+2H2O=2KOH+O2↑+H2O2;
(3)酸性最强的HClO4,根据化合物化合价之和为零,则氯元素的化合价为+7,可作半导体材料的元素是硅;反应H2+Cl2![]() 2HCl中,H2和Cl2是同种元素形成的单质,只含有非极性共价键,HCl是不同元素组成的化合物,只含有极性共价键,化学反应的实质为旧键的断裂和新键的形成,因此,涉及到非极性键断裂和极性键的形成。
2HCl中,H2和Cl2是同种元素形成的单质,只含有非极性共价键,HCl是不同元素组成的化合物,只含有极性共价键,化学反应的实质为旧键的断裂和新键的形成,因此,涉及到非极性键断裂和极性键的形成。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】PET是一种聚酯纤维,拉伸强度高,透光性好,广泛用作手机贴膜,合成如下:

下列关于该高分子的说法不正确的是
A. 合成PET的反应为缩聚反应
B. PET与聚乙二酸乙二酯具有相同的重复结构单元
C. PET膜应避免与碱性物质(如NaOH)长期接触
D. 通过质谱法测定PET的平均相对分子质量,可得其聚合度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学化学常见物质,一定条件下它们有如图转化关系(其他产物已略去),下列说法错误的是( )
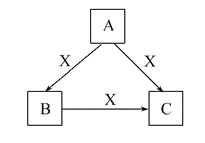
A. 若X为Cl2,则C可能为FeCl3
B. 若X为KOH溶液,则A可能为AlCl3
C. 若X为O2,则A可能为硫化氢
D. 若A、B、C均为焰色反应呈黄色的化合物,则X可能为CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】文献表明:工业上,向炽热铁屑中通入氯化氢生产无水氯化亚铁;相同条件下,草酸根(C2O42-)的还原性强于Fe2+。为检验这一结论,雅礼中学化学研究性小组进行以下实验:
资料:i. 草酸(H2C2O4)为二元弱酸。
ii. 三水三草酸合铁酸钾[K3Fe(C2O4)33H2O]为翠绿色晶体,光照易分解。其水溶液中存在[Fe(C2O4)3]3-![]() Fe3++3C2O42- K=6.3×10-21
Fe3++3C2O42- K=6.3×10-21
iii.FeC2O42H2O为黄色固体,溶于水,可溶于强酸。
(实验1)用以下装置制取无水氯化亚铁
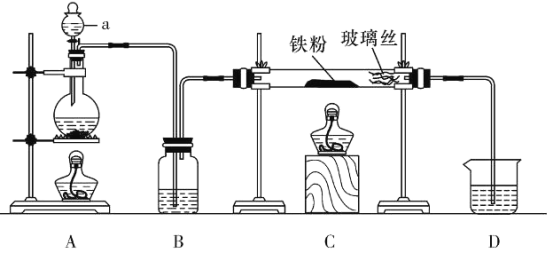
(1)仪器a的名称为___________。
(2)欲制得纯净的FeCl2,实验过程中点燃A、C酒精灯的先后顺序是___________。
(3)若用D的装置进行尾气处理,存在的问题是__________、___________。
(实验2)通过Fe3+和C2O42-在溶液中的反应比较Fe2+和C2O42-的还原性强弱。

(4)取实验2中少量晶体洗浄,配成溶液,漓加KSCN溶液,不变红。继续加入硫酸,溶液变红,说明晶体中含有+3价的铁元素。加硫酸后溶液变红的原因是______________。
(5)经检验,翠绿色晶体为K3Fe(C2O4)33H2O。设计实验,确认实验2中没有发生氧化还原反应的操作和现象是_____。
(6)取实验2中的翠绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:_____Fe(C2O4)3]3-+____H2O![]() ____FeC2O4·2H2O↓+__________+_______
____FeC2O4·2H2O↓+__________+_______
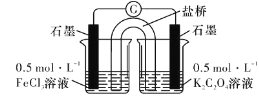
(实验3)研究性小组又设计以下装置直接比较Fe2+和C2O42-的还原性强弱,并达到了预期的目的。
(7)描述达到期目的可能产生的现象:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D四种物质均含有铁元素,彼此转化关系如下:

请回答:
(1)反应①称为铝热反应(属于置换反应),写出该反应的化学方程式:__、其中Al作__剂。
(2)反应④的离子方程式为:__。
(3)新配制的C溶液中应加入__,以防止其转化为D。检验D溶液中阳离子的常用试剂是__(填化学式),实验现象为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种短周期元素x、y、z对应的单质X、Y、Z,常温常压下均为无色气体,在适当条件下单质X、Y、Z之间可以发生如图所示的变化。已知B分子组成中z原子个数比C分子中多一个。

请回答下列问题:
(1)元素x的原子结构示意图___;元素y在周期表中的位置是___;
(2)写出单质氟与C反应的离子反应方程式:___。
(3)Y与X在一定条件下生成化合物A的化学方程式:___。
(4)一定条件下,将盛有10mLA的大试管倒置于水槽的水中然后缓缓通入Y至液体刚好充满试管,写出反应的化学方程式___;通入相同状况下气体Y的体积为___。
(5)用电子式表示B的形成过程___。
查看答案和解析>>
科目:高中化学 来源: 题型:
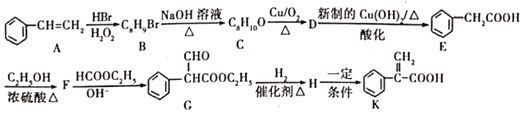
【题目】已知:苯和卤代烃在催化剂的作用下可以生成烷基苯和卤化氢,C是生活中常见的有机物,乙苯能被酸性高锰酸钾溶液氧化为苯甲酸。几种物质之间的转化关系如图所示(生成物中所有无机物均已略去)。

请回答下列问题:
(1)写出物质的结构简式:A____________,C___________,E____________。
(2)在①~⑥6个反应中,属于消去反应的是________(填编号,下同),属于酯化反应的是________。
(3)写出下列反应的化学方程式:
①_____________________________________________________;
②____________________________________________________;
⑥_____________________________________________________。
H→I_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】RLClaisen双酯缩合反应的机理如下:2RCH2COOC2H5![]()
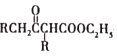 +C2H5OH,利用该反应制备化合物K的一种合成路线如图
+C2H5OH,利用该反应制备化合物K的一种合成路线如图
试回答下列问题:
(1)A与氢气加成所得芳香烃的名称为______;A→B的反应类型是______;D中含氧官能团的名称是______。
(2)C的结构简式为______;F→G的反应除生成G外,另生成的物质为______。
(3)H→K反应的化学方程式为______。
(4)含有苯环结构的B的同分异构体有______种(B自身除外),其中核磁共振氢谱显示3组峰的结构简式为______(任写一种即可)。
(5)乙酰乙酸乙酯(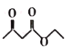 )是一种重要的有机合成原料,写出由乙醇制备乙洗乙酸乙時的合成路线(无机试剂任选):______。
)是一种重要的有机合成原料,写出由乙醇制备乙洗乙酸乙時的合成路线(无机试剂任选):______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应由两步反应A![]() B
B![]() C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述不正确的是( )
C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述不正确的是( )
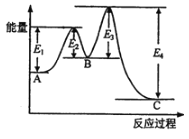
A. A→C的反应为放热反应 B. 稳定性C>A>B.
C. A→C的反应中,△H=(E2+E4)-(E1+E3) D. 加入催化剂不会改变反应的焓变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com