
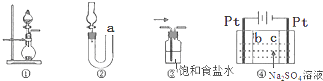
| A. | 图①可用于实验室制取少量NH3或O2 | |
| B. | 可用从a处加水的方法检验图②装置的气密性 | |
| C. | 实验室可用图③的方法除去Cl2中混有的HCl | |
| D. | 利用图④装置制硫酸和氢氧化钠,其中b为阳离子交换膜 |
分析 A.图为固体与液体反应不加热制取气体的装置;
B.从a处加水,左右两侧形成液面差;
C.HCl极易溶于水,食盐水抑制氯气的溶解;
D.左侧与电源正极相连为阳极,氢氧根离子放电,右侧氢离子放电.
解答 解:A.图为固体与液体反应不加热制取气体的装置,则浓氨水与碱石灰反应制取氨气,过氧化氢与二氧化锰制氧气均可,故A正确;
B.从a处加水,左右两侧形成液面差,则可检验图②装置的气密性,故B正确;
C.HCl极易溶于水,食盐水抑制氯气的溶解,则可用图③的方法除去Cl2中混有的HCl,故C正确;
D.左侧与电源正极相连为阳极,氢氧根离子放电,右侧氢离子放电,则利用图④装置制硫酸和氢氧化钠,其中b为阴离子交换膜,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及气体的制备、气密性检查、混合物分离提纯、电解等,把握物质的性质、反应原理及实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
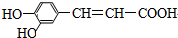
| A. | 只有②④⑤⑥ | B. | 只有①③④⑥ | C. | 只有①②③⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | Cl2 | Br2 | I2 | H2 | HF | HCl HBr HI |
| 能量 | 243 | 193 | 151 | 436 | 568 | 432 366 298 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X Y | Z |
| ①NaOH溶液 Al(OH)3 | 稀硫酸 |
| ②KOH溶液 SiO2 | 氢氟酸 |
| ③O2 N2 | H2 |
| ④FeCl3溶液 Cu | 浓硝酸 |
| A. | ①③ | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
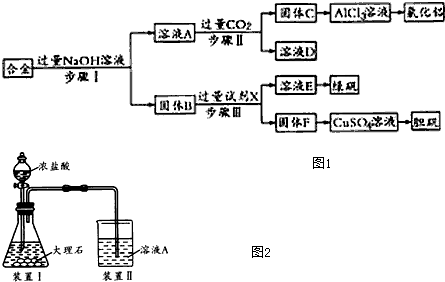
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B)=0.075mol/(L•s) | B. | v(A)=0.030mol/(L•s) | C. | v(C)=0.040mol/(L•s) | D. | v(D)=0.060mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com