
����Ŀ��ijѧϰС��ͨ�������ʵ��һ��ʵ�����̽��ijЩ��ѧ���ۣ�
��1��ʵ��һ���Է�Ӧ2Fe3++2I��=2Fe2++I2Ϊ���� ̽���÷�Ӧ�Ƿ�Ϊ���淴Ӧ��
ʵ�鷽������KI��Һ�еμ�3mLFeCl3��Һ�������Һ��
�ȷֵ��ס��ҡ�����֧�Թ��У����Թܼ��еμӵ���
��Һ�����Թ����еμ�KSCN��Һ����ͼ��ʾ��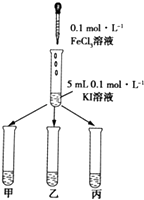
���Թܼ��г�������
���Թ��г�������
��˵���÷�ӦΪ���淴Ӧ��
��2��ʵ�����ʵ�����Ʊ�CO2�ķ�Ӧ��ʵ������е����ݼ������Ϣ���±���
��� | ��Ӧ�¶�/�� | C��HCl��/molL��1 | V��HCl��/mL | 10g̼��Ƶ���״ | t/min |
�� | 20 | 2 | 10 | ��״ | t 1 |
�� | 20 | 4 | 10 | ��״ | t 2 |
�� | 20 | 2 | 10 | ��ĩ | t 3 |
�� | 40 | 2 | 10 | ��ĩ | t 4 |
�� | 40 | 4 | 10 | ��ĩ | t5 |
��t��ʾ�ռ���ͬ״���������Ϊa mL CO2�����ʱ���
��i���ɱ����е���Ϣ��֪ʵ�����Ŀ����̽��
��ii��ʵ��ٺ�ʵ�����̽���Ըû�ѧ��Ӧ���ʵ�Ӱ�죬���������е���Ϣ��֪���Ըû�ѧ��Ӧ���ʵ�Ӱ�����ػ���
��iii���ռ�a mL CO2�����ʱ�����ٵ�ʵ��������ʵ����ţ�
���𰸡�
��1��������Ѫ��ɫ
��2��Ӱ�컯ѧ��Ӧ���ʵ����أ�Ũ�ȣ��¶ȡ��Ӵ��������
���������⣺��1����֤����Ӧ2Fe3++2I��=2Fe2++I2Ϊ���淴Ӧ��Ҫ֤����Һ��ͬʱ���������Ӻ͵ⵥ�ʣ���KI��Һ�еμ�3mLFeCl3��Һ�������Һ���ȷֵ��ס��ҡ�����֧�Թ��У����Թܼ��еμӵ�����Һ�����Թ����еμ�KSCN��Һ�����Թܼ��г�����ɫ֤���ⵥ�ʴ��ڣ����Թ��г���Ѫ��ɫ��Һ֤���������ӣ�˵����Ӧ�ǿ��淴Ӧ�����Դ��ǣ���ɫ��Ѫ��ɫ����2����i��ͼ�����ݷ�����֪���٢ڢۢܢ���ʵ��Ŀ����̽��Ӱ�컯ѧ��Ӧ���ʵ����أ���Ҫ���¶ȡ�Ũ�ȡ��Ӵ�����Ի�ѧ��Ӧ���ʵ�Ӱ�죬�ı�һ���������Ի�ѧ��Ӧ����Ӱ�죬�ɱ����е���Ϣ��֪ʵ�����Ŀ����̽��Ӱ�컯ѧ��Ӧ���ʵ����أ�
���Դ��ǣ�Ӱ�컯ѧ��Ӧ���ʵ����أ���ii��ʵ��ٺ�ʵ���������Ũ�Ȳ�ͬ����������ͬ��̽��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬��Ũ���⣬ͼ�����¶ȡ��Ӵ����Ҳ��Ӱ�컯ѧ��Ӧ���ʣ�
���Դ��ǣ�Ũ�ȣ� �¶ȡ��Ӵ��������iii������ʵ�������֪�Ի�ѧ��Ӧ����Ӱ�������¶����ߣ��¶�Խ�߷�Ӧ����Խ�죬��Ӧ��Ҫ��ʱ��Խ�̣��Ӣܢ���ѡ�ڢ���ʵ��������Ũ�ȴ�Ӧ���ʿ�����ʱ��̣�
���Դ��ǣ��ݣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ΪԪ�����ڱ��е�һ���֣��û�ѧʽ��Ԫ�ط��Żش��������⣺
| ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
�� | �� | �� | �� | |||||
�� | �� | �� | �� | �� | �� | |||
�� | �� | �� |
��1���������γ��������������Ԫ������дԪ�����ƣ�����Ԫ����Ԫ�����ڱ��е�λ���� �� д����Ԫ�ض�Ӧ���������������Ʒ�Ӧ�Ļ�ѧ����ʽ ��
��2���٢ڢ��У�����������Ӧ��ˮ���������ǿ���� �� ��д��ѧʽ�� �����Ӧ����̬�⻯����ȶ��ԴӴ�С��˳���� �� ���û�ѧʽ��ʾ��
��3��Ԫ�آߵ��⻯�����ʽΪ �� ���⻯��������ۺ����ᷴӦ���ɵĻ������к��еĻ�ѧ�������� �� �������������ӡ����ۡ���
��4���ж�Ԫ�آܺ͢��Ӧ�ij������������Ե�ǿ�����û�ѧʽ��ʾ�������û�ѧ����ʽ��������жϣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ���Թ�����һ��������Ƭ��������ϡ���ᷴӦ���õ����������������ʱ��仯��ͼ��b�����������������䣬�ı�һ����Ӧ�������õ�ͼ��a������ı�����������ǣ� �� 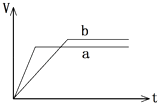
A.���Թ��еμ���������ͭ��Һ
B.�ڷ�Ӧ�����ж��Թܼ���
C.�����۴�����Ƭ
D.��98%��Ũ�������ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������������������ʵ��ǣ� ��
A.����
B.������
C.�
D.ʳ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڼ����Ԫ�صı�����ȷ����(����)
A. ������Ƕ�Ӧ�����н�������ǿ��Ԫ��B. �������µ�������������
C. Li��Na��K���ʾ�Ӧ������ú����D. Li��Na��Kȼ�վ����ɹ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������һ�ֹ�ҵ��������Ҫ�ɷ�ΪMgCO3��Mg2SiO4������Fe��Al�������Ϊԭ���Ʊ�MgCO33H2O��ʵ�������ͼ1��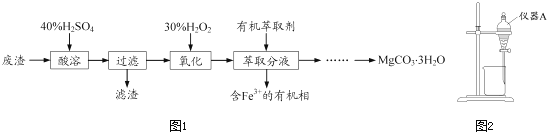
��1�����ܹ�������Ҫ��Ӧ���Ȼ�ѧ����ʽΪ
MgCO3��S��+2H+��aq���TMg2+��aq��+CO2��g��+H2O��l����H=��50.4kJmol��1
Mg2SiO4��s��+4H+��aq���T2Mg2+��aq��+H2SiO3��s��+H2O��l����H=��225.4kJmol��1
��������ȵ�Ŀ����������H2SO4���˹���̫���ԭ���� ��
��2������H2O2����ʱ������Ӧ�����ӷ���ʽΪ ��
��3����ͼ2��ʾ��ʵ��װ�ý�����ȡ��Һ���Գ�ȥ��Һ�е�Fe3+ ��
��ʵ��װ��ͼ������A������Ϊ ��
��ΪʹFe3+�����ܶ�ش�ˮ��ת�����л��࣬��ȡ�IJ�������װ��ˮ��Һ������A�м���һ�������л���ȡ���������á���Һ�����ظ���Σ�
��4���벹����������ȡ��õ���ˮ��Һ�Ʊ�MgCO33H2O��ʵ�鷽�����߽��������Һ�еμӰ�ˮ�� �� ���ˡ���ˮϴ�ӹ���2��3�Σ���50���¸���õ�MgCO33H2O��
[��֪����Һ��pH=8.5ʱMg��OH��2��ʼ������pH=5.0ʱAl��OH��3������ȫ]��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ�ӵ�ԭ�ӽṹ������ͼ�ı�ʾ���������ʾ�����С��ʾ���ӻ���ӣ����ʾ���ӣ����йآ٢ڢ۵�������ȷ���ǣ� �� 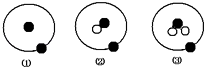
A.�٢ڢ��ǻ�ѧ���ʲ�ͬ������
B.�ٲ��Ǻ��أ��ڢ۲��Ǻ���
C.�٢ڢ۾�����ͬ��������
D.�٢ڢۻ�Ϊͬλ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ȼ�ѧ����ʽ�ó��Ľ�����ȷ���ǣ� ��
A.��֪2H2��g��+O2��g��=2H2O��g������H=��483.6 kJmol��1������ȼ����Ϊ241.8 kJmol��1
B.��֪NaOH��ag��+HCl��aq��=NaCl��aq��+H2O��l������H=��57.4 kJmol��1 �� ��20.0g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28.7kJ/mol������
C.��֪C��ʯī��s��=C�����ʯ��s������H��0����ʯī�Ƚ��ʯ�ȶ�
D.��֪C��s��+O2��g��=CO2��g������H1C��s��+1/2O2��g��=CO��g������H2 �� ���H1����H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cl2��SO2����ʹƷ����Һ��ɫ�����������ʵ�����Cl2��SO2��Ϻ���ͨ��Ʒ����BaCl2�Ļ����Һ���ܹ۲쵽�������Ǣ���Һ�ܿ���ɫ����Һ����ɫ �۳��ֳ����ܲ����ֳ���
A. �٢� B. �٢� C. �ڢ� D. �ڢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com