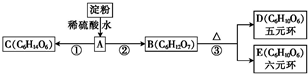
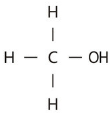
甲醇是一种具有广泛应用前景的物质.回答下列与甲醇相关的问题.
(1)甲醇分子的结构式为
.
(2)工业上可以用CO和H
2制备CH
3OH.反应原理为CO(g)+2H
2(g)?CH
3OH(g)△H=-86.6kJ?mol
-l.
①达到平衡后,若改变某个条件使平衡向正反应方向移动,则下列说法中正确的有
(填字母)
A.反应物的转化率一定增大
B.正反应速率一定大于逆反应速率
C.生成物的体积分数一定增加
D.反应物的浓度一定降低
E.平衡常数K有可能不变
F.容器中混合气体平均摩尔质量一定不变
②若在一恒温、体积可变的密闭容器中,以物质的量之比1:2加入CO和H
2,t
1时刻达平衡后,在t
2时刻改变某一条件,其反应过程如图1所示.则t
2时刻改变的条件可能为
.
(3)甲醇可做燃料电池,用以电解某M混合溶液.如图2所示:
①Y电极为
极(填正或“负”或“阴”或“阳”),X电极的电极方程式为
.
②若M溶液为200 mL,由如下离子构成:
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol?L-1 | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(同种条件)的气体时停止电解.则阳极上收集到的氧气的质量为
g.此时,负极区中n(H
+)的变化量为
mol.



 ,故答案为:
,故答案为: ;
;