
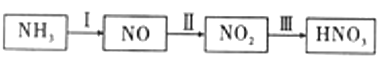
【题目】硝酸工业与合成氨工业密切相关,氨氧化法是工业生产中制取硝酸的主要途径,其主要流程如图:
I. 在一容积为2L的密闭容器内加入2molN2和6molH2,在一定条件下合成氨气,已知N2(g)+3H2(g)![]() 2NH3 △H<0。反应中NH3的物质的量浓度的变化情况如图所示
2NH3 △H<0。反应中NH3的物质的量浓度的变化情况如图所示

(1)根据图示,计算从反应开始到第4分钟达到平衡时,平均反应速率υ(N2)为______
(2)达到平衡后,第5分钟末,若保持其它条件不变,只改变反应温度,则NH3的物质的量浓度不可能为________(填序号)。
a. 0. 8mol/L b.1.0mol/L. c.1.2mol/L d. 2. mol/L
(3)达到平衡后,第5分钟末,若保持其它条件不变,只把容器的体积缩小,新平衡时NH3的浓度恰好为原来的2倍,则新体积_________(选填“大于”“等于”或“小于”)二分之一倍的原体积。
Ⅱ.某小组同学欲探究由NH3制取HNO3的过程,设计按如图所示装置进行试验。
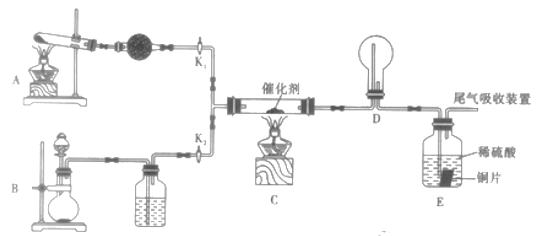
(1)A装置中发生反应的化学方程式为_________________________________。
(2)B装置制备的物质为_________________。(填序号)
A . NH3 B Cl2 C.O2 D. HCl
(3)该实验中能够证明有二氧化氮产生的现象为_______________________。
(4)已知E中装有2mol/L的硫酸150mL和足量铜片,若E中出现溶液变蓝色的现象,所有反应的铜均转化为CuSO4,则至少需要产生标况下_______L氨气(假设各步反应均完全进行)。
【答案】0.125mol·L1·min1 bd 大于 Ca(OH)2+2NH4Cl![]() CaCl2 + 2NH3↑+2H2O C D中出现红棕色气体 4.48
CaCl2 + 2NH3↑+2H2O C D中出现红棕色气体 4.48
【解析】
Ⅰ.(1)4分钟达平衡时由图可知c(NH3)=1.0mol/L,则4分钟内N2的浓度变量为0.5mol/L,所以υ(N2)=0.125mol·L1·min1;
(2)由于反应不能完全进行,所以NH3的物质的量浓度不可能为2.0mol/L,无论是升温还是降温反应平衡均将移动,所以不能为1.0mol/L。选择bd两个选项。
(3)假设改变容器的体积,平衡不移动,则要使NH3的浓度恰好为原来的2倍,容器体积将缩小为原来的1/2,但是该反应正向为气体体积缩小的反应,容器的体积缩小后平衡将正向移动,所以缩小后体积将大于原体积的1/2。
Ⅱ.(1)由于干燥氨气只能选择碱石灰,所以A装置必须为制取氨气的装置,根据装置特征可判断为固固加热制气体的反应,所以发生的反应为Ca(OH)2+2NH4Cl![]() CaCl2+ 2NH3↑+2H2O。
CaCl2+ 2NH3↑+2H2O。
(2)因为NH3制取HNO3的过程需要氧气参加反应,所以除制取NH3外,还需要制备氧气,所以选C。
(3)在C装置中,NH3催化氧化变成NO,在D中与O2反应生成NO2,呈红棕色能说明有NO2生成。
(4)若E中所有反应的铜均转化为CuSO4,则说明生成的HNO3全部作氧化剂,由于反应方程式为3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O,E中硫酸为0.3mol,所以消耗的HNO3为0.2mol,由于各步反应完全转化,所以根据氮元素守恒,所需NH3的最小值为0.2mol,标况下的体积为4.48L。


科目:高中化学 来源: 题型:
【题目】某软锰矿的主要成分为![]() ,还含有
,还含有![]() 等杂质,用该软锰矿制备
等杂质,用该软锰矿制备![]() 的流程图如图:
的流程图如图:
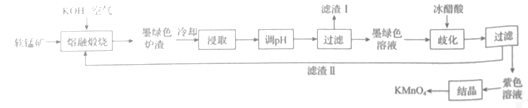
已知:I.![]() 固体和溶液均为黑绿色;
固体和溶液均为黑绿色;
II.![]() 溶液中存在以下平衡:
溶液中存在以下平衡:![]()
回答下列问题:
(1)“熔融煅烧”时,![]() 参与反应的化学方程式为_____。
参与反应的化学方程式为_____。
(2)“浸取“过程中,为加快浸取速率。可以采取的措施有____(写出两点)。向浸取液中通入![]() 调节其pH,经“过滤”得滤渣I,滤渣I的成分是____(填化学式)。
调节其pH,经“过滤”得滤渣I,滤渣I的成分是____(填化学式)。
(3)“歧化”时,加入冰醋酸的目的是____。“歧化”时,下列酸可以用来代替冰醋酸的有____(填字母)。
a.乙二酸 b.亚硫酸 c.氢溴酸 d.稀硫酸
(4)“结晶”时,当___时,停止加热,自然冷却,抽滤后即可获得紫黑色![]() 晶体。
晶体。
(5)已知![]() 能与热的硫酸酸化的
能与热的硫酸酸化的![]() 反应生成
反应生成![]() 和
和![]() 。取上述制得的
。取上述制得的![]() 产品7.0g,恰好与13.4g
产品7.0g,恰好与13.4g![]() 完全反应,则
完全反应,则![]() 的纯度为____%(结果保留1位小数)。
的纯度为____%(结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20mLcmol·L-1KOH溶液中滴加0.1mol·L-1HCOOH溶液,混合溶液中水电离的氢氧根离子浓度与滴加甲酸(弱酸)溶液体积(V)的关系如图所示。下列说法正确的是
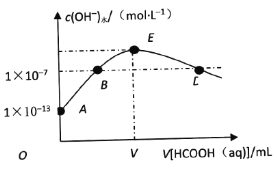
A. 上述KOH溶液的浓度c=0.01mol·L-1
B. B点对应的溶液中:c(K+)=c(HCOO-)
C. E点对应的溶液中:c(OH-)>c(H+)=c(HCOOH)
D. 若D点对应的甲酸溶液体积为V1mL,则HCOOH电离平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、Cu2+、CO32—、SO42—、NO3—中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法错误的是
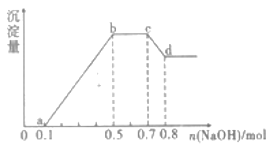
A. 溶液中的阳离子有H+、Mg2+、Al3+、NH4+
B. cd段的离子方程式为Al(OH)3+OH—=AlO2—+2H2O
C. 溶液中n(NH4+)=0.2mol
D. n(H+):n(Mg2+):n(Al3+)=1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列反应:
①Fe+CuSO4=Cu+FeSO4
②CaO+H2O=Ca(OH)2
③Ba(OH)2+H2SO4 =BaSO4↓+2H2O
④Zn+2HCl=ZnCl2+H2↑
⑤2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
⑥CaCO3![]() CaO+CO2↑
CaO+CO2↑
⑦2CO+O2![]() 2CO2
2CO2
⑧SO42-+Ba2+=BaSO4↓
(1)反应①中,氧化剂是______________________。
(2)反应③的离子反应方程式为_________________________________________。
(3)写出一个符合⑧的化学反应方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性KMnO4溶液和CuS混合时,发生的反应如下:MnO4-+CuS+H+→Cu2++SO2↑+Mn2++H2O,下列有关该反应的说法中正确的是( )
A.被氧化的元素是Cu和S
B.![]() 的还原性强于CuS的还原性
的还原性强于CuS的还原性
C.氧化剂与还原剂的物质的量之比为6:5
D.若生成2.24LSO2,转移电子的物质的量是6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液中,产物中可能含有KCl、KClO、KClO3,且![]() 的值与温度高低有关。当n(KOH)=a mol时,下列说法不正确的是
的值与温度高低有关。当n(KOH)=a mol时,下列说法不正确的是
A.参加反应的氯气的物质的量等于![]() a mol
a mol
B.改变温度,产物中KClO3的最大理论产量为![]() a mol
a mol
C.改变温度,反应中转移电子的物质的量n(e-)的范围为![]() a mol≤n(e-)≤
a mol≤n(e-)≤![]() a mol
a mol
D.若某温度下,反应后![]() =11,则溶液中
=11,则溶液中![]() =
=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
(1)物质的量浓度均为0.1molL﹣1的四种溶液:pH由小到大排列的顺序是_______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1molL﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_____(填字母)_______
A. c(H+) B.![]() C. c(H+)c(OH﹣) D.
C. c(H+)c(OH﹣) D. ![]() E.
E. ![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
c(CH3COO﹣)﹣c(Na+)=________(填准确数值)。
(5)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为____________________________________
(6)标准状况下,将1.12L CO2通入100mL 1molL﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A分子内含有碳碳双键,并有如下转化关系:

请回答:
(1)E的分子式是_____________,C的结构简式是____________。
(2)反应①、②,分别属于的反应类型是①___________、②_____________
(3)写出反应B ![]() C的化学方程式__________________________________
C的化学方程式__________________________________
(4)写出两分子E酯化生成六元环酯的化学方程式:_______________________________________
(5)A有多种同分异构体,写出满足下列条件的一种同分异构体的结构简式:_________
a.分子中有苯环,且能使溴水褪色 b.苯环上有两个间位取代基
(6)写出E在一定条件下发生消去后的产物合成高分子的化学方程式__________________________________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com