
【题目】依据Cd(Hg)+Hg2SO4=3Hg+Cd2++SO42-反应原理,设计出韦斯顿标准电池,其简易装置如图。下列有关该电池的说法正确的是
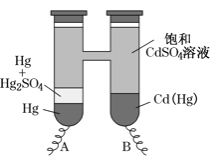
A.电池工作时Cd2+向电极B移动
B.反应中每生成amolHg转移2amol电子
C.电极B上发生的反应:Cd(Hg)-4e-=Hg2++ Cd2+
D.电极A上发生的反应:Hg2SO4+2e-=2Hg+ SO42-
【答案】D
【解析】
根据反应原理分析,Cd(Hg)为合金材料,金属的化合价均为0,其中的Cd失去电子,作负极,发生的电极反应为Cd(Hg)-2e-=Cd2++Hg;而Hg2SO4得到电子,作正极,电极反应为Hg2SO4+2e-=2Hg+SO42-。
A.原电池中,阳离子向正极移动,A为正极,则Cd2+向电极A移动,A错误;
B.根据反应原理,每生成3molHg,转移2mol电子,则每生成amolHg转移![]() mol电子,B错误;
mol电子,B错误;
C.Cd(Hg)中Hg的化合价没有变化,仍为0价,则电极反应为Cd(Hg)-2e-=Cd2++Hg,C错误;
D.根据反应原理,在A极上,Hg2SO4得到电子生成Hg单质,电极方程式为Hg2SO4+2e-=2Hg+ SO42-,D正确。
答案选D。


 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】苯与液溴制取溴苯:

(1)装置A的名称是_______________。
(2)制取溴苯的化学反应方程式_____________。
(3)反应时,装置B中出现的现象有___________。
(4)冷凝水顺序_______(A.上进下出;B.下进上出),长导管的作用____________,请解释装置C中导管位置为什么不能伸入液面以下____________。
(5)装置D的作用是__________。
(6)反应结束后,将滴液漏斗中的溶液E加入到烧瓶B中,充分振荡后可除去溴苯中的溴,溶液E是_______________;液体经过分液,所得的溴苯中还含有少量苯,如何进行分离________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图:
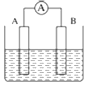
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为______。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成原电池的负极反应式_________。
(2)若A为Pb,B为PbO2,电解质为硫酸溶液,写出B电极反应式:_________;该电池在工作时,A电极的质量将______(填“增重”或“减轻”或“不变”)。若消耗0.1moLH2SO4时,则转移电子数目为______。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃烧电池,写出A电极反应式:_________;该电池在工作一段时间后,溶液的碱性将______(填“增强”或“减弱”或“不变”)。
(4)若A、B均为铂片,电解质为硫酸溶液,分别从A、B两极通入CH4和O2,该电池即为甲烷燃烧电池,写出A电极反应式:_________;电池工作时阴离子定向移动到______极(填“正”或“负”)。
(5)铁、铜、铝是生活中使用广泛的金属,FeCl3溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为_________,若将此反应设计成原电池,则负极所用电极材料为______,正极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源的利用具有广阔前景。
(1)下图是从海水中提取镁的简单流程。

①工业上常用于沉淀Mg2+的试剂A是_____________。
②由无水MgCl2制取Mg的化学方程式是_______________。
(2)海带灰中富含以I-形式存在的碘元素.实验室提取I2的途径如下所示:
干海带![]() 海带灰
海带灰![]() 滤液
滤液![]()
![]() I2
I2
①灼烧海带至灰烬时所用的主要仪器名称是___________ 。
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式______________。
③反应结束后,加入CCl4作萃取剂,采用萃取—分液的方法从碘水中提取碘,主要操作步骤如图:

甲、乙、丙3步实验操作中,不正确的是_________ (填“甲”、“乙”或“丙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列图示的说法中正确的是

A. 用图①所示实验可比较氯、碳、硅三种元素的非金属性强弱
B. 用图②所示实验装置通过排空气法收集CO气体
C. 图③所示装置可用于探究温度对H2O2分解反应速率的影响
D. 图④两个装置中通过导线的电子数相相同时,生成的H2的物质的量也相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出9种元素在周期表中的位置,请按要求回答问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ |
(1)⑦的简单离子的结构示意图是______。表中标注的元素的最高价氧化物对应的水化物中碱性最强的碱是_____(填写化学式)。③、④、⑨三种元素按原子半径由大到小的顺序排列为 ______ (用元素符号表示)。
(2)元素②的气态氢化物的电子式是_______。由3个元素②的原子组成带一个单位负电荷的阴离子中含有_______个电子。写出该元素氢化物与其最高价氧化对应水化物反应的离子方程
式_____________。
(3)⑦、⑧两元素简单离子还原性强弱为______(填离子符号)。
(4)某研究性学习小组设计了一组实验验证元周期律。
Ⅰ:甲同学在A、B两只烧杯里分别加入50mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的③、⑨元素单质,观察现象。甲同学设计实验的目的是_____。写出元素⑨的单质与水反应的化学方程式为________。
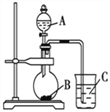
Ⅱ:乙同学设计如图装置以验证①、⑥、⑦元素的非金属性强弱。为了达到实验目的,仪器A、B、C分别选择的药品为A______、B______、C______;烧杯中发生反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C燃烧时呈现黄色火焰,C的单质在点燃条件下与B的单质充分反应,可以得到淡黄色固态化合物,D的M层电子数为K层电子数的3倍.试根据以上叙述回答:
(1)写出元素名称:A D ;
(2)画出D的原子结构示意图 ;
(3)用电子式表示化合物C2D的形成过程 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中充入一定量的N2O5,发生反应: 2N2O5(g)![]() 4NO2(g)+O2(g),能判断反应已经达到平衡状态的是
4NO2(g)+O2(g),能判断反应已经达到平衡状态的是
A. NO2和O2的浓度比保持不变B. 容器中的压强不再变化
C. 2υ正(NO2)=υ逆(N2O5)D. 气体的平均相对分子质量为43.2,且保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com