
 某离子晶体的晶体结构如图所示,试求:
某离子晶体的晶体结构如图所示,试求:| m |
| V |
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| V |
| 4M |
| ρNA |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||


科目:高中化学 来源: 题型:
| X |
| X |
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
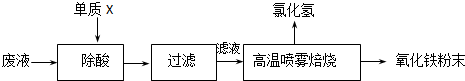
| 操作步骤 | 预期现象和结论 |
| 步骤1.取少量样品于试管1中, | 样品全部溶解,得到澄清的溶液. |
| 步骤2. 步骤3. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 加入试剂 | 操作方法 |
| ①粗苯甲酸的提纯 | ||
| ②乙醇(水) | ||
| ③乙酸乙酯(乙酸) | ||
| ④乙烷(乙烯) | ||
| ⑤苯(酒精) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA |
| B、标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
| C、在0℃、1.01KPa下,22.4L的NO气体与11.2L的O2混合,气体分子数为NA |
| D、在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
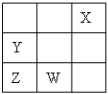
| A、通常情况下四种元素的单质中X化学性质最稳定 |
| B、四种元素不都能与氢元素形成稳定的化合物 |
| C、Y.Z离子最外层电子数相同 |
| D、四种元素中Z元素最高价氧化物对应的水化物酸性最强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com