
| A.都不正确 | B.只有①③⑤正确 |
| C.只有②④⑤正确 | D.只有①②⑥正确 |
科目:高中化学 来源:不详 题型:单选题
| A.分子间形成的氢键使物质的熔点和沸点升高; |
| B.冰中存在氢键,水中不存在氢键; |
| C.每一个水分子内含有两个氢键; |
| D.H2O是一种非常稳定的化合物,这是由于氢键所致 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
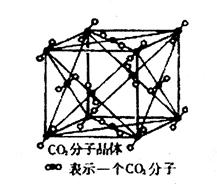
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


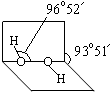
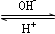 R(OH)3
R(OH)3 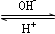 [R(OH)4]-
[R(OH)4]-查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 :
: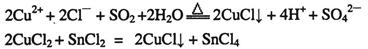
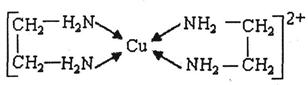
 。
。 中氮原子轨道的杂化类型为 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_ 。
中氮原子轨道的杂化类型为 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_ 。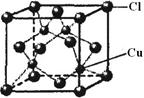
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.两种分子中心原子的杂化类型不同 |
| B.两种分子中键的极性和分子的极性不同 |
| C.NH3分子中存在有一对未成键的孤对电子 |
| D.氨气分子之间和甲烷分子之间的作用力类型不同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com