
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用 元素符号或化学式 填空回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在③~⑦元素中,原子半径最大的是_________,其离子的原子结构示意图为_____________
(2)①~⑩元素中,最不活泼的元素是____________,元素的最高价氧化物对应的水化物中酸性最强的酸是___________, 碱性最强的碱是_____________,呈两性的氢氧化物是
(3)按要求填写: ①的氢化物的电子式__________________;用电子式表示 ③和⑦形成化合物的形成过程__________________________________________;
(4)② ⑦和⑩的单质的氧化性由强到弱顺序是_________________________________,可用说明⑦和⑩的单质氧化性强弱的反应事实是(用化学反应方程式表示):__________________________________
【答案】Na  Ar HClO4 KOH Al(OH)3
Ar HClO4 KOH Al(OH)3 ![]()
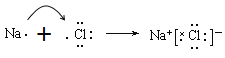 F2>Cl2>Br2 2NaBr+Cl2=2NaCl+Br2
F2>Cl2>Br2 2NaBr+Cl2=2NaCl+Br2
【解析】
根据元素周期表的结构分析,①~⑩中元素分别为氮、氟、钠、镁、铝、硅、氯、氩、钾、溴。据此回答。
(1)③~⑦元素为第三周期元素,原子半径从左到右依次减小,所以其中原子半径最大的是钠,其离子的结构示意图为 。
。
(2)①~⑩元素中,最不活泼的元素是稀有气体元素Ar,非金属性越强,最高价含氧酸的酸性越强,则元素的最高价氧化物对应的水化物中酸性最强的酸是HClO4,金属性越强,最高价水化物的碱性越强,则碱性最强的碱是KOH,呈两性的氢氧化物是Al(OH)3;
(3)①的氢化物是氨气,含有共价键的共价化合物,电子式为![]() ;③和⑦形成化合物是离子化合物氯化钠,用电子式表示③和⑦形成化合物的形成过程为
;③和⑦形成化合物是离子化合物氯化钠,用电子式表示③和⑦形成化合物的形成过程为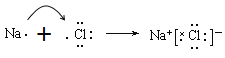 ;
;
(4)同主族从上到下非金属性逐渐减弱,则②、⑦和⑩的单质的氧化性由强到弱顺序是F2>Cl2>Br2,氯气能置换出溴可说明⑦和⑩的单质氧化性强弱,则反应的方程式为2NaBr+Cl2=2NaCl+Br2。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中不正确的是( )
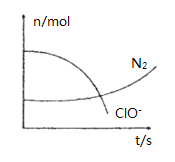
A. 还原剂是含CN-的物质,氧化产物只有N2
B. 氧化剂是ClO-,HCO3-是氧化产物
C. 参与反应的氧化剂与还原剂的物质的量之比为5:2
D. 标准状况下若生成2.24LN2,则转移电子1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种利用锂电池“固定CO2”的电化学装置,在催化剂的作用下,该电化学装置放电时可将CO2转化为C和Li2CO3,充电时选用合适催化剂,仅使Li2CO3发生氧化反应释放出CO2和02。下列说法中正确的是

A. 该电池充电时,阳极反应式为:C+2Li2CO3-4e-=3CO2↑+4Li
B. 该电池放电时,Li+向电极X方向移动
C. 该电池充电时,电极Y与外接直流电源的负极相连
D. 该电池放电时,每转移4mol电子,理论上生成1molC
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(CB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。某兴趣小组设计实验方案对葡萄酒中SO2进行测定。
I.定性实验方案如下:
(1))利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如下实验:

实验结论:干白葡萄酒不能使品红溶液褪色,原因是:___________。
II.定量实验方案如下(部分装置和操作略):

(2)A中加入100.0mL葡萄酒和适量盐酸,加热使SO2全部逸出并与B中H2O2完全反应,其化学方程式为________________。
(3)除去B中过量的H2O2,然后再用NaOH标准溶液进行滴定,除去H2O2的方法是_______。
(4)步骤X滴定至终点时,消耗NaOH溶液30.00mL,该葡萄酒中SO2的含量为_____g/L。该测定结果比实际值偏高,分析原因__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 水的电离方程式:H2O = H++ OH-
B. pH=7的溶液一定是中性溶液
C. 升高温度,水的电离程度增大
D. 将稀醋酸加水稀释时,c(H+)减小,c(OH-)也减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH=1的溶液中,可以大量共存的离子组是 ( )
A. Na+、K+、S2-、Cl-B. Al3+、Mg2+、SO42-、Cl-
C. K+、Na+、HCO3-、NO3-D. K+、Na+、SO42-、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在图(Ⅰ)所示的装置中,烧杯中盛放的是Ba(OH)2溶液,当从滴定管中逐渐加入某种溶液A时,溶液的导电性的变化趋势如图(Ⅱ)所示。
(Ⅰ)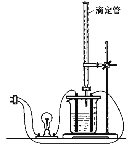 (Ⅱ)
(Ⅱ)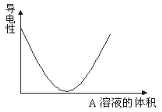
(1)滴加液体至图(Ⅱ)中曲线最低点时,灯泡可能熄灭,可能的原因是______________。
(2)试根据离子反应的特点分析,溶液A中含有的溶质可能是(填序号)____________。
①HCl ②H2SO4 ③NaHSO4 ④NaHCO3
(3)已知0.1 mol·L-1NaHSO4溶液中c(H+)=0.1 mol·L-1,请回答下列问题:
①写出NaHSO4在水溶液中的电离方程式_______________________________。
②NaHSO4属于________(填“酸”、“碱”或“盐”)。
③向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:_______;在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:_________。写出NaHSO4溶液与NaHCO3溶液混合的离子方程式_________。
(4)有以下物质:①石墨; ②氯化氢气体; ③酒精; ④铝; ⑤二氧化碳; ⑥碳酸氢钠固体;⑦氢氧化钡溶液; ⑧液态醋酸; ⑨氯化银固体; ⑩氨气。
①其中能导电的是:____________________________;
②属于非电解质的是:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
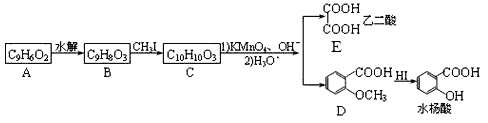
【题目】香豆素是广泛存在于植物中的一类芳香化合物,大多具有光敏性,有的还具有抗菌和消炎作用。它的核心结构是芳香内酯A,其分子式为C9H6O2,该芳香内酯A经下列步骤转变为水杨酸和和化合物E。
已知:CH3CH = CHCH2CH3![]() CH3COOH + CH3CH2COOH
CH3COOH + CH3CH2COOH
请回答下列问题:
(1)C中官能团的名称为________;化合物A的结构简式为________。
(2)C生成D和E的反应类型为________,化合物E的化学名称是________。
(3)写出B→C的化学反应方程式_________ 。
(4)化合物D有多种同分异构体,其中一类同分异构体是苯的二元取代物,且水解后生成的产物之一能发生银镜反应。这类同分异构体共有________种;写出其中核磁共振氢谱有4种峰,且其信号强度之比为1:2:2:3的一种同分异构体的结构简式________ 。
(5)已知: R- CH=CH2![]() R-CH2CH2Br,请设计合理方案由
R-CH2CH2Br,请设计合理方案由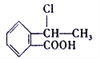 合成
合成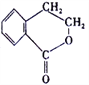 (其他无机原料自选,用反应流程图表示,并注明反应条件)。_______。示例:原料
(其他无机原料自选,用反应流程图表示,并注明反应条件)。_______。示例:原料![]() ……产物
……产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把铁片放入盛有过量稀硫酸的试管中,不影响氢气产生速率的因素是( )
A. 硫酸的浓度B. 铁片的表面积
C. 溶液的温度D. 加少量Na2SO4固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com