
| A. | NH3 | B. | KOH | C. | H2SO4 | D. | NaClO |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
| 实验方案 | 预计能产生的现象 | 实验结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为△H=-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 已知H2O(l)═H2O(g)△H=+44 kJ/mol,则2 g H2(g)完全燃烧生成液态水比生成气态水多释放22 kJ的能量 | |
| C. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H<0 | |
| D. | 1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者△H小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠在氯气中燃烧,有白雾生成 | |
| B. | 铜在氯气中燃烧,生成蓝色的氯化铜颗粒 | |
| C. | 红热的铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体 | |
| D. | 氢气在氯气中燃烧产生大量的白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸发结晶的方法分离碳酸钠和水 | |
| B. | 用过滤的方法分离植物油和水 | |
| C. | 用蒸馏的方法分离乙酸(沸点118℃)与乙酸乙酯(沸点118℃) | |
| D. | 用萃取和分液的方法用CCl4从碘水提取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 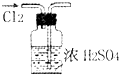 干燥Cl2 | B. | 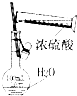 配制100ml 0.1mol•L-1硫酸溶液 | ||
| C. | 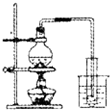 制取少量蒸馏水 | D. | 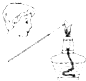 检验钾元素的存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20mL0.3 mol•L-1Na2CO3 | B. | 10mL0.4 mol•L-1Na2CO3 | ||
| C. | 25mL0.4 mol•L-1Na2CO3 | D. | 15mL0.5 mol•L-1Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com