
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| ① | 160 | $\frac{2}{3}$ | 1 |
| ② | x | $\frac{2}{3}$ | 5 |
| ③ | 260 | y | 5 |
分析 (1)①反应热=反应物总键能-生成物总键能;
②Ⅰ.CO(g)+2H2(g)?CH3OH(g)△H
Ⅱ.2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-204.7kJ•mol-1,
由盖斯定律,Ⅱ-Ⅰ×2可得:2CH3OH(g)=CH3OCH3(g)+H2O(g);
(2)①根据v=$\frac{△c}{△t}$计算v(H2),再利用速率之比大于化学计量数之比计算v(CO);
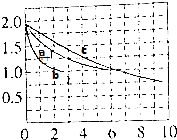
②与a相比,b到达平衡时间短,且平衡时氢气浓度不变,平衡不移动,而正反应为气体物质的量减小的反应,压强影响平衡移动,则b使用催化剂;
温度越高,反应速率越快,到达平衡的时间越短;
③计算平衡时各组分的浓度,根据K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算平衡常数;a的温度比c高,平衡时氢气浓度比c的大,说明升高温度平衡逆向移动,平衡常数减小,而a、b温度相同,二者平衡常数相同;
采取控制变量法分析,①与②压强不同,则温度、投料比相同;②与③温度不同,投料比相同.
解答 解:(1)①反应热=反应物总键能-生成物总键能,则:CO(g)+2H2(g)?CH3OH(g)的△H=1076kJ/mol+2×436kJ/mol-3×408kJ/mol-351kJ/mol-463kJ/mol=-90kJ/mol,
故答案为:-90kJ/mol;
②Ⅰ.CO(g)+2H2(g)?CH3OH(g)△H=-90kJ/mol
Ⅱ.2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-204.7kJ•mol-1,
由盖斯定律,Ⅱ-Ⅰ×2可得:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=-24.7kJ/mol,
故答案为:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=-24.7kJ/mol;
(2)①v(H2)=$\frac{2mol-1mol/L}{3min}$=$\frac{1}{3}$mol/(L.min),速率之比大于化学计量数之比,则v(CO)=$\frac{1}{2}$v(H2)=$\frac{1}{6}$mol/(L.min),
故答案为:$\frac{1}{6}$mol/(L.min);
②与a相比,b到达平衡时间短,且平衡时氢气浓度不变,平衡不移动,而正反应为气体物质的量减小的反应,压强影响平衡移动,则b使用催化剂;
a与c相比,a达到平衡时间较短,温度越高,反应速率越快,到达平衡的时间越短,故温度a>c,
故答案为:b中使用催化剂;c;
③起始时氢气浓度为2mol/L,则CO的起始内为1mol/L,平衡时氢气浓度为1mol/L,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L):1 2 0
变化量(mol/L):0.5 1 0.5
平衡量(mol/L):0.5 1 0.5
故平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{0.5}{0.5×{1}^{2}}$=1,
a的温度比c高,平衡时氢气浓度比c的大,说明升高温度平衡逆向移动,平衡常数减小,而a、b温度相同,二者平衡常数相同,故平衡常数c>a=b,
采取控制变量法分析,①与②压强不同,则温度、投料比相同,故x=160;②与③温度不同,投料比相同,则y=$\frac{2}{3}$,
故答案为:1;c>a=b;160;$\frac{2}{3}$.
点评 本题考查化学平衡有关计算、化学平衡图象、化学平衡常数、化学反应速率计算、反应热计算、热化学方程式书写等,侧重考查学生的分析计算能力,注意对基础知识的理解掌握.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol ${\;}_{92}^{235}$U核素含有中子数为235NA | |
| B. | 1 L 0.l mol•L-1的醋酸溶液中含有H+数目为0.1NA | |
| C. | 标准状况下,22.4L乙烯和丙烯的混合气体中含有的碳原子数目为2.5NA | |
| D. | 常温常压下,l.6gCH4中含有共价键总数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LSO3中硫原子数与1L0.1mol•L-1Na2SO3溶液中硫原子数相同 | |
| B. | 1mol•L-1FeCl3溶液全部制成胶体,其中含胶粒的数目小于NA | |
| C. | 1molNa2O2中含有NA个阴离子 | |
| D. | 1L0.5mol•L-1Na2SO4溶液中阴离子所带电荷数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该混合溶液中有:c(Na+)+c(H+)=c(HC2O4-)+c (OH-)+2 c (C2O42-) | |
| B. | 该混合溶液中有:c (Na+)=2 (c(HC2O4-)+c (H2C2O4)+c (C2O42-)) | |
| C. | 该混合溶液中有:c (OH-)-c(H+)=c(HC2O4-)+2 c (H2C2O4) | |
| D. | 该混合溶液中有:c (Na+)>c (C2O42-)>c(HC2O4-)>c (OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
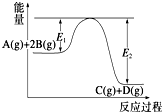
| A. | 该反应为放热反应 | |
| B. | 当反应达到平衡时,降低温度,A的转化率增大 | |
| C. | 升高温度,平衡常数K减小;压强增大,平衡向正反应方向移动 | |
| D. | 加入催化剂,反应速率增大,E1减小,E2减小,反应热减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com