
现代医学证明,硒是人体中14种必需的营养元素之一,缺硒与贫血、冠心病、不孕症、癌症等疾病直接相关.因此,硒被誉为“生命的奇效元素”.已知硒元素与氧元素同主族,则下列关于硒的叙述中不正确的是()
A. H2Se比H2O稳定
B. 最高价氧化物的水化物化学式为H2SeO4
C. 它有两种氧化物SeO2和SeO3
D. 其单质常温下呈固态
考点: 同一主族内元素性质递变规律与原子结构的关系.
专题: 元素周期律与元素周期表专题.
分析: 根据第ⅥA族元素性质的相似性和递变性,根据已知的氧元素和硫元素的性质推断硒元素的性质,同主族从上到下非金属性逐渐减弱,对应的氢化物的稳定性逐渐减弱,最高价氧化物中硒元素为+6价,对应的水化物为H2SeO4,根据硫元素的常见氧化物为二氧化硫和三氧化硫,可以推出硒元素的常见氧化物为SeO2和SeO3,根据硫元素在常温下为固态,可知硒元素在常温下也为固体等来解题.
解答: 解:A、氧元素位于第二周期第ⅥA族,硒元素位于第四周期第ⅥA族,同主族,从上到下元素的非金属性逐渐减弱,对应氢化物的稳定性逐渐减弱,故稳定性水更稳定,故A错误;
B、第ⅥA族元素的最高化合价为+6价,故硒元素的最高价氧化物对应水化物为H2SeO4,故B正确;
C、硒元素常见正化合价有+4、+6,对应的氧化物SeO2和SeO3,故C正确;
D、硒单质的物理性质中在常温下为固态,根据氧在常温下为气体,硫在常温下为固态,可以推出硒常温下为固态,故D正确;
故选A.
点评: 本题考查了同主族元素性质的相似性和递变性,同主族元素从上到下非金属性逐渐减弱,相应的最高正化合价等于主族序数,根据已知元素和比较熟悉的元素推测相关元素的物理和化学性质等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
请完成下列填空:
(1)同温同压下等体积的SO2和SO3中,所含原子数之比为 .
(2)中和100mL 0.1mol/L的稀硫酸,需NaOH的质量为
(3)现有m g某气体,它由双原子分子构成,它的摩尔质量为M g•mol﹣1,则:
①该气体在标准状况下的体积为
②该气体溶于水后形成V L溶液(不考虑反应),其溶液的物质的量浓度 L﹣1.
查看答案和解析>>
科目:高中化学 来源: 题型:
把VL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含amolNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含bmolBaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸根,则原混合溶液中钾离子的浓度为()
A. 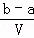 mol/L B.
mol/L B. 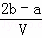 mol/L C.
mol/L C. 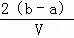 mol/L D.
mol/L D. 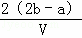 mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验兴趣小组按如图装置实验后,所记录内容合理的是()
实验
记录 ①Cu为正极,Zn为负极;
②Zn质量减少,Cu质量不变;
③SO42﹣ 向Cu极移动;
④电子流方向是:由Zn经导线流入Cu片;
⑤Zn电极发生还原反应;
⑥正极反应式:Cu2++2e﹣═Cu

A. ①④⑥ B. ②③④ C. ①②⑤ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
现有部分短周期元素的性质与原子(或分子)结构如下表:
元素编号 元素性质与原子(或分子)结构
T 最外层电子数是次外层电子数的3倍
X 常温下,单质为双原子分子,分子中含有3对共用电子对,其简单氢化物的水溶液显碱性
Y M层比K层少1个电子
Z 第3周期元素的简单离子中半径最小的,其氧化物呈两性
(1)画出元素T原子结构示意图 ;
(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是 (填序号);
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式为 .
(4)元素T和氢元素以原子个数比1:1形成的化合物的电子式为 ,元素Z最高价氧化物的水化物与元素Y的最高价氧化物的水化物的溶液相互反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
除去NaCl中含有的Ca2+、Mg2+、SO42﹣、HCO3﹣等离子,通常采用以下四种试剂:①Na2CO3 ②BaCl2 ③NaOH ④HCl,加入试剂合理的操作顺序是()
A. ①②③④ B. ③①②④ C. ④②①③ D. ③②①④
查看答案和解析>>
科目:高中化学 来源: 题型:
在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后()
A. 整个溶液变紫色 B. 整溶液变为棕黄色
C. 上层为无色下层为紫红色 D. 下层无色上层紫红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com