
部分中学化学常见元素原子结构及性质如下表所示:
| 元素 | 结构及性质 |
| A | A单质是生活中的常见金属,它有两种氯化物,相对分子质量相差35.5 |
| B | B原子最外层电子数是内层电子总数的1/5 |
| C | C是常见化肥的主要元素,单质常温下呈气态 |
| D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| E | 通常情况下,E没有最高正化合价,其单质之一是空气的一种主要成分 |
| F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
(1)A元素在周期表中的位置为______________。
(2)B与C形成的化合物的化学式为________,它属于________(填“离子”或“共价”)化合物。
(3)①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X与Y的水溶液的实验方法是____________________________;
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的水溶液显______性,N的结构式为______________________。
(4)B~F各元素原子半径由小到大的顺序是__________(用元素符号表示)。
答案 (1)第四周期第Ⅷ族
(2)Mg3N2 离子
(3)①分别取X、Y各少许置于试管中,再各加入少量的MnO2粉末,迅速产生无色气体的是H2O2;无明显现象的是H2O(其他合理答案也可)
②碱 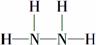
(4)H<O<N<Si<Mg
解析 A为常见的具有两种价态(化合价相差1价)的金属,只能是铁元素(Fe);B只有镁元素(Mg)符合条件;N、P、K三种元素形成的单质中,只有N2常温下是气体,C为氮元素(N);硅单质是半导体材料,D为硅元素(Si);E没有最高正化合价,是一种很活泼的非金属,又是空气的成分,只能是氧元素(O);F为氢元素(H)。
(1)Fe位于第四周期第Ⅷ族。
(2)Mg与N形成的化合物为Mg3N2,属于离子化合物。
(3)①可以利用MnO2能够催化分解H2O2产生氧气区别H2O和H2O2;②H2O、H2O2的电子数分别为10、18,N和H形成的10个电子和18个电子的化合物分别为NH3和N2H4,其中N2H4的结构式为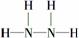 。
。


科目:高中化学 来源: 题型:
1995年,化学家合成了一种分子式为C200H196,含有多个碳碳叁键的链烃.该分子中最多含有碳碳叁键( )
|
| A. | 49个 | B. | 50个 | C. | 51个 | D. | 53个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在溶液中,反应A+2B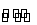 C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 mol·L-1、c(B)=0.200 mol·L-1及c(C)=0 mol·L-1。反应物A的浓度随时间的变化如图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 mol·L-1、c(B)=0.200 mol·L-1及c(C)=0 mol·L-1。反应物A的浓度随时间的变化如图所示。
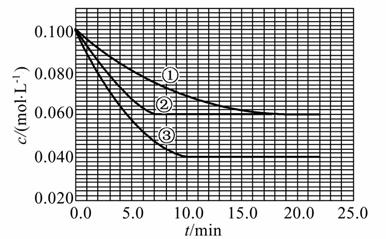
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②_________________________________________________________________;
③_________________________________________________________________;
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为_______;
(3)该反 应的ΔH________0,判断其理由是______________________________;
应的ΔH________0,判断其理由是______________________________;
(4)该反应进行到4.0 min时的平均反应速率:
实验②:vB=____________________________;
实验③:vC=____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是(双选)( )
A.质子数c>d
B.离子半径Y2->Z-
C.氢化物的稳定性H2Y>HZ
D.原子半径W<X
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是元素周期表中短周期的一部分,若A原子的最外层电子数比次外层电子数少3,则下列说法正确的是( ) 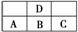
A.元素A、B、C的最高价氧化物对应水化物的酸性;C>B>A
B.D的最高正价与B的最高正价相等
C.D与C不能形成化合物
D.原子半径:C>B>A>D
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)某反应池发生“生物硝化”过程,利用O2将NH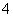 氧化成NO
氧化成NO ,如果不考虑过程中硝化细菌的增殖,其反应如下所示:
,如果不考虑过程中硝化细菌的增殖,其反应如下所示:
 请完成上述离子方程式的配平。
请完成上述离子方程式的配平。
(2)请将下列五种物质:KBr、Br2、I2、KI、K2SO4分别填入下列横线上,若I2和KBr的化学计量数分别是8和1,请组成一个配平的化学方程式
________KBrO3+________+________H2SO4―→________+________+________+________+________H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关离子检验的操作和实验结论都正确的是( )
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 | 该溶液中一定含有SO |
| B | 向某溶液中同时加入几滴KSCN溶液和少量新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体 | 该溶液中一定含有CO |
| D | 向某溶液中加入NaOH并微热,产生能够使湿润的红色石蕊试纸变蓝的无色气体 | 该溶液中一定含有NH |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关Fe2(SO4)3溶液的叙述正确的是( )
A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3++2I-===Fe2++I2
C.和Ba(OH)2溶液反应的离子方程式:Fe3++SO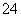 +Ba2++3OH-===Fe(OH)3↓+BaSO4↓
+Ba2++3OH-===Fe(OH)3↓+BaSO4↓
D.1 L 0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,可逆反应N2(g)+3H3(g) ===2NH3(g)ΔH<0达到平衡,当单独改变下列
条件后,有关叙述错误的是 ( )
A.加催化剂,v(正)、v(逆)都发生变化,且变化的倍数相等
B.加压,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
C.降温,v(正)、v(逆)都减小,且v(正)减小的倍数小于v(逆)减小的倍数
D.加入氩气,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com