
 ⑤
⑤ ⑧
⑧ ⑨
⑨ .
. 分析 一般来说,活泼金属与非金属形成离子键,非金属元素之间形成共价键,含有离子键的化合物属于离子化合物,只含有共价键的化合物属于共价化合物,先判断化合物的类型,再根据书写规则书写电子式;以此来解答.
解答 解:①N2只存在共价键,属于单质;
②MgCl2只存在离子键,属于离子化合物;
③NH4Cl存在离子键和共价键,属于离子化合物;
④CH4只存在H-C共价键,属于共价化合物;
⑤CO2只存在共价键,属于共价化合物;
⑥Ne 中不存在化学键,属于单质;
⑦H2S 只存在共价键,属于共价化合物;
⑧KOH 存在离子键和共价键,属于离子化合物;
⑨Na2O2存在离子键和共价键,属于离子化合物;
⑩K2O只存在离子键,属于离子化合物;
只存在共价键的是 ①④⑤⑦;属于离子化合物,但含有共价键的是 ③⑧⑨.
③NH4Cl是离子化合物,由氨根离子与氯离子构成,电子式为: ;
;
⑤CO2中存在两对碳氧共用电子对,二氧化碳的电子式为: ;
;
⑧KOH 为离子化合物,由钾离子和氢氧根离子构成,氢氧化钾的电子式为: ;
;
⑨Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ;
;
故答案为:①④⑤⑦;③⑧⑨; ;
; ;
; ;
; .
.
点评 本题考查化学键、电子式的书写,把握化学键形成的一般规律为解答的关键,注意特殊物质中的化学键(铵盐、氯化铝)即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 某温度时pH=6的纯水中含有10-6NA个H+ | |
| B. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA | |
| C. | 在25℃、1.01×105Pa时,121gCF2Cl2所含的氯原子数为2NA | |
| D. | 常温下,5.6g铁投入到足量的浓硝酸中,反应转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
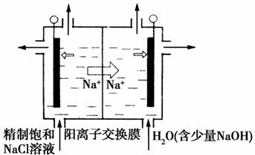 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 4 | 4 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 1mol/L的稀硝酸中,氧原子数为3NA | |
| B. | 常温常压下的67.2L氯气与54g铝充分反应,转移电子数为6NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电数为0.2NA | |
| D. | 标准状况下,80gSO3,中含3NA心个氧原子,体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFe与足量的Cl2反应转移的电子数为2NA | |
| B. | 标准状况下,22.4L水中含有的水分子数为NA | |
| C. | 常温、常压下,22gCO2中含有的氧原子数为NA | |
| D. | 0.11mol/LCaCl2溶液中含氧离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
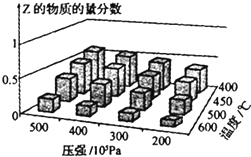 为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数.实验结果如图所示,下列判断正确的是( )
为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数.实验结果如图所示,下列判断正确的是( )| A. | △H>0 | |
| B. | 升温,正、逆反应速率都增大,平衡常数减小 | |
| C. | 增大压强,Z的含量减小 | |
| D. | 在恒温恒容下,向已达到平衡的体系中加入少量Z,达到平衡后Z的含量减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com