
【题目】2016年10月17日7点30分,神舟十一号载人飞船发射升空。制造航天飞船的主要材料是铝,工业上制铝时用冰晶石(Na3AlF6)做助熔剂,冰晶石制备流程有如下两种:
方案一:以纯碱和萤石(CaF2)为主要原料
![]()
方案二:以碳酸氢铵和六氟合硅酸为主要原料

(1)方案一中B可作为建筑材料,化合物A 是________,写出由C制备冰晶石的化学方程式____________________________。
(2)方案二中反应1产生的气体是_____________,反应2后滤液中主要成分的用途_________。
(3)方案二中反应2化学方程式________________________。
(4)工业电解制铝的阴极反应式为_________________,以石墨为电极维持电流180千安电解5小时生成铝270千克,则电流效率η(η=实际产量/理论产量)为_______。(法拉第常数F = 96500 C·mol-1)
【答案】 浓硫酸 12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O CO2 用作氮肥 12NH4Cl+Al2(SO4)3+Na2SO4= 2Na3AlF6↓+(NH4)2SO4 Al3++3e-=Al 89.4%
【解析】(1)B是常用建筑材料为硫酸钙,故A是浓硫酸,气体C是HF,反应是HF与Na2CO3、Al(OH)3反应,故方程式为12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O;
(2)从元素守恒看气体是CO2,滤液的中主要成分是(NH4)2SO4,常用作氮肥;
(3)化学方程式为12NH4Cl+Al2(SO4)3+Na2SO4= 2Na3AlF6↓+(NH4)2SO4;
(4)阴极反应式为Al3++3e-=Al,电量Q=180×103A×5h=180×103×5×3600C,电解生成的铝转移电子电量为![]() C,电流效率为η=
C,电流效率为η=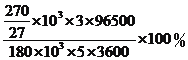 =89.4%。
=89.4%。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】把等物质的量的Na2SO4、NaCl、AgNO3混合物放入足量水中,经充分搅拌后,将
所得溶液用石墨电极进行电解,阳极生成的物质是( )
A. H2 B. Ag C. Cl2 D. O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法中
①结构片段为…… ……的高聚物,其单体是甲醛和苯酚
……的高聚物,其单体是甲醛和苯酚
②标准状况下,22.4LHF所含电子数约为10NA
③甲醇通常是一种有毒的气体,分子中只含极性键
④苯酚和碳酸钠溶液的反应:![]()
⑤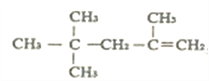 的名称为:2,4,4,-三甲基-1-戊烯
的名称为:2,4,4,-三甲基-1-戊烯
⑥3-甲基-1-丁烯中的所有碳原子不可能处于同一平面
⑦等物质的量的苯与苯甲酸完全燃烧消耗氧气的量不相等
其中正确的有 个。
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 符合通式CnH2n+2且n不同的烃一定属于同系物
B. C60和纳米碳管互为同素异形体
C. 宇宙射线的作用下可使14N转化为14C,14N和14C互为同位素
D. C5H12的某种同分异构体只有一种一氯代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的化学方程式为_________________。

图甲
(2)NO是有毒气体。某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
A.铁 B.铝
C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是________________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。

图乙
①长玻璃管的作用是______________________________________________。
②让反应停止的操作方法及原因是________________________________。
以下收集NO气体的装置,合理的是________(填选项代号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于取代反应的是( )
A. 淀粉在一定条件下水解生成葡萄糖
B. 苯与浓硝酸、浓硫酸混合共热制取硝基苯
C. 在催化剂存在条件下,乙烯与水反应制乙醇
D. 油脂在碱性条件下水解制肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,向三个初始体积均为1L的密闭容器中按下表所示投料,发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)△H<0。达到平衡进,下列说法正确的是
2SO3(g)△H<0。达到平衡进,下列说法正确的是
容器编号 | 容器类型 | 起始物质的量/mol | 平衡时SO3的 物质的量/mol | ||
SO2 | O2 | SO3 | |||
Ⅰ | 恒温恒容 | 2 | 1 | 0 | 1.2 |
Ⅱ | 绝热恒容 | 0 | 0 | 2 | a |
Ⅲ | 恒温恒压 | 2 | 1 | 0 | b |
A. 平衡时SO3的物质的量:a>1.2、b>1.2
B. 容器Ⅱ、Ⅲ中平衡常数相同
C. 容器I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1
D. 若起始时向容器Ⅰ中充入1.0molSO2(g)、0.40molO2(g)和1.40molSO3(g),则此时V正<V逆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com