
A��B��C��DΪ������ѧ��ѧ�г����ĵ��ʡ�����ʱAΪ����ɫ���壬BҲ�ǹ�����B�ɱ��Ż���C��D��˫ԭ�ӷ��ӵ����壬C�ʻ���ɫ��E��F��G��H��IΪ���ֻ����E������ˮ��FΪ���壬�Ҽ�������ˮ����ɫ������Һ��H����ˮ��û�ɫ���ػ�ɫ��Һ������֮�������·�Ӧ��ת����ϵ��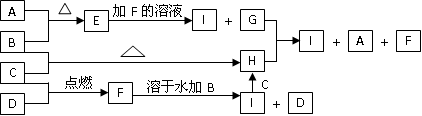
��1���������ʵĻ�ѧʽ��B________��C_______��E________��F_______��
��2������I��Һ����ɫ��_______ɫ��
��3����ʵ�鷽������H��I����__________�Լ���������_________________�� ��4��д��G+H I+A+F�����ӷ���ʽ_______________________________��
��4��д��G+H I+A+F�����ӷ���ʽ_______________________________��
��1��B��Fe C��Cl2 E��FeS F��HCl
��2��dz��ɫ
��3��KSCN ��Һ��Ѫ��ɫ
��4��2Fe3+ + H2S = 2Fe2+ + S + 2H+
���� AΪ����ɫ���壬AΪS; BҲ�ǹ�����B�ɱ��Ż�, BΪFe; C�ʻ���ɫ CΪCl2�� DΪH2�� EΪFeS; FΪHCl; GΪH2S; HΪFeCl3 ;IΪFeCl2
��1��B��Fe C��Cl2 E��FeS F��HCl
��2��dz��ɫ
��3��KSCN ��Һ��Ѫ��ɫ
��4��2Fe3+ + H2S = 2Fe2+ + S + 2H+



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�



�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com