
如图利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )
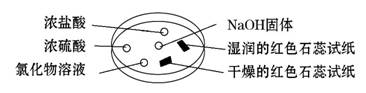
| 选项 | 实验现象 | 解释 |
| A | 浓盐酸附近产生白烟 | NH3与浓盐酸反应生成了NH4Cl固体 |
| B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
| C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
| D | 干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
科目:高中化学 来源: 题型:
雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)  N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10 min内,NO的平均反应速率v(NO)=_______________________,T1℃时,该反应的平衡常数K=______________________________。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是__________ (填字母)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30 min后升高温度至T2℃,达到平衡时,容器中,NO、N2、CO2的浓度之比为5:3:3,则Q______________ (填“>”、“=”或“<”)0。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
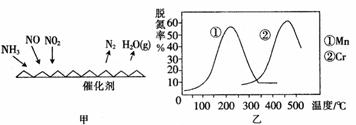
①由图甲可知,SCR技术中的氧化剂为_______________。已知c(NO2):c(NO)=1:1时脱氮效果最佳,若生成1 mol N2时反应放出的热量为Q kJ。此时对应的脱氮反应的热化学方程式为__________________________。
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳的催化剂和相应的温度分别为___________________________。
(3)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收。该温度下,吸收液中c(Ca2+)一直保持为0.70 mol·L-1,已知Ksp(CaSO3)=1.4×10-7,求吸收后溶液中的SO32-的浓度_______________。(写出计算过程,结果保留2位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
空气吹出法是最早工业化海水提溴的方法,适合从低浓度含溴溶液中提取溴。
 |
(1)NaBr的电子式是 。
(2)反应①是将Br—转化为Br2,反应①的离子方程式是 。
(3)通入空气吹出Br2,并用Na2CO3吸收的目的是 。
(4)反应②的化学方程式是 。
(5)反应③中每生成3 mol Br2,转移电子的物质的量是 mol。
(6)为了除去工业Br2中微量的Cl2,可向工业Br2中 (填字母)。
a.通入HBr b.加入NaBr溶液 c.加入Na2CO3溶液 d.加入Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2)。分子内存在空腔,能嵌入某微粒并形成4个氢键予以识别。下列微粒中,能被该有机化合物识别的是
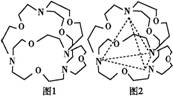
A.CF4 B.CH4 C.NH4+ D.H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
硅是重要的半导体材料,构成了现代电子工业的基础。
(1)基态Si原子中,电子占据的最高能层符号为____________。
(2)硅也有系列氢化物-----硅烷,SiH4分子中H原子的1s轨道与Si原子的__________轨道重叠形成Si—H σ键。
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,这种变化关系原因是
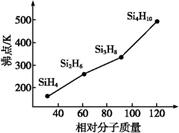
___________________________________________________________________________。
(4)科学家们在高温高压下将CO2制成与SiO2结构类似的新型CO2晶体。这种新型CO2晶体与SiO2相比,熔点更高的是____________________;原因是__________________
___________________________________________________________________________。
(5)在硅酸盐中,Si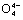 四面体[如下图(a)]通过共用顶角氧离子可形成多种结构型式。图(b)为一种无限长单链结构的多硅酸根X;
四面体[如下图(a)]通过共用顶角氧离子可形成多种结构型式。图(b)为一种无限长单链结构的多硅酸根X;
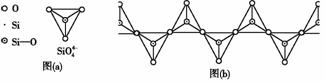
X中Si与O的原子数之比为________________,化学式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列递变规律正确的是( )
A.P、S、C1最高正价依次降低 B.钠、镁、铝的还原性依次减弱
C.HC1、HBr、HI的稳定性依次增强 D.HC1O、H2SO4、H3PO4的酸性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列烷烃:①正己烷 ②丙烷 ③正戊烷 ④正丁烷 ⑤癸烷中,沸点由高到低的顺序正确的是( )
A.①②③④⑤ B.⑤①③④② C.⑤③④①② D.③④⑤②①
查看答案和解析>>
科目:高中化学 来源: 题型:
向溶有10.1g KNO3的水溶液中撒入17.28g 铜粉,微热,铜粉不溶解,慢慢滴入2mol·L-1的稀硫酸,
铜粉开始溶解,溶液显蓝色,并有少量气泡出现。该实验中反应的离子方程式:
3 Cu + 8H+ + 2NO3- == 3 Cu 2+ + 2NO ↑ + 4H2O
(1)当滴入 mL硫酸后铜粉不再溶解;此时烧杯底应该残留 g铜粉;
(2)为使杯底的铜粉全部溶解,在加入足量硫酸的前提下,还应该再加入至少 g KNO3固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中不正确的是( )
A.用容量瓶配制一定物质的量浓度的NaOH溶液时,溶解后的溶液要马上转移至容量瓶
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.蒸发结晶时当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干
D.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com