
【题目】现有下列仪器或装置,请回答下列问题:
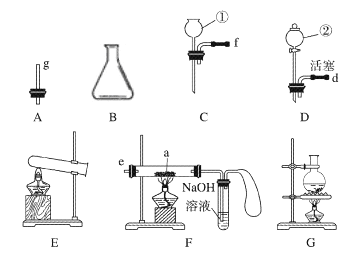
(1)仪器①的名称是_____,②的名称是_____。
(2)用上图仪器组装成气体发生装置:用KClO3和MnO2制O2应选的装置是______(填字母);用H2O2与MnO2制O2,并控制产生O2的速率,应选_____(填字母)。
(3)若用装置X进行“排空气法”收集制取的CO2,CO2应从_____(填“b”或“c”)端导入。若瓶中装满水,用排水法收集氧气,氧气应从_____(填“b”或“c”)端导入。
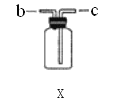
(4)若用F装置进行CO还原Fe2O3的实验,实验室制取CO的方法一般采用甲酸脱水法(HCOOH![]() CO
CO![]() +H2O),用纯净的CO完成该实验。
+H2O),用纯净的CO完成该实验。
①除F、X外还需要的装置有_____(填字母),X中应加入的试剂是_____,X与其他导管连接的顺序是_____(填导管口的序号);
②实验时 F装置中气球的作用是_____。
【答案】长颈漏斗 分液漏斗 AE BD c b DG 浓硫酸 dcbe 收集尾气中的一氧化碳,防止污染
【解析】
本题考查的是常用气体的发生装置和收集装置及选取方法。锥形瓶是常用的反应容器,长颈漏斗方便加液体药品;制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热。氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集。若用图X装置进行“排空气法”收集制取O2,氧气应从长管进入,因为氧气的密度比空气的密度大;若瓶中装满水,用排水法收集氧气,氧气应从短管进入,因为氧气的密度比水小;若用F装置进行CO还原Fe2O3的实验,装置中气球的作用是吸收生成的二氧化碳。
(1)根据仪器的外形特征可知仪器①为长颈漏斗,仪器②为分液漏斗。本小题答案为:长颈漏斗;分液漏斗。
(2) 用KClO3和MnO2制O2的反应物是固体需要加热,还需要用导气管将气体导出,应选的发生装置为AE;用H2O2与MnO2制O2的反应物是液体,不需要加热,反应容器用锥形瓶即可,由于分液漏斗有开关,可以通过开关调节液体的流速,从而控制反应速度,应选择的发生装置为BD。本小题答案为:AE;BD。
(3)若用图X装置进行“排空气法”收集制取的CO2,CO2应从长管(即c端)进入,因为CO2的密度比空气的密度大;若瓶中装满水,用排水法收集氧气,氧气应从短管(即b端)进入,因为氧气的密度比水小。本小题答案为:c;b。
(4) ①甲酸脱水法制取一氧化碳的反应物是液体需要加热,应选的发生装置为G,由于分液漏斗有开关,可以通过开关调节浓硫酸的流速,还应用到的发生装置为D;制取CO时会携带出一部分水蒸气,而用CO还原Fe2O3的实验中需用纯净的CO,则X中应加入的试剂是浓硫酸,用于吸收CO中的水蒸气,且气体应从长管进短管出,则X与其他导管连接的顺序是dcbe。本小题答案为:DG;浓硫酸;dcbe。
②完成该实验后因为一氧化碳有毒污染空气,所以必须进行尾气处理,将一氧化碳收集起来再处理。本小题答案为:收集尾气中的一氧化碳,防止污染。


科目:高中化学 来源: 题型:
【题目】下列图示的实验设计能达到相应实验目的的是
A. 检验溴乙烷消去的产物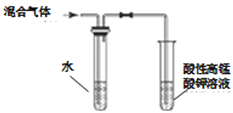
B. 检验FeCl3溶液中是否混有Fe2+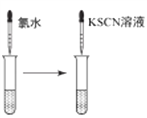
C. 检验亚硫酸钠溶液是否变质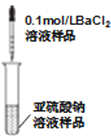
D. 验证钢铁的析氢腐蚀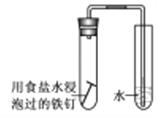
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按下图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液。请回答下列问题:
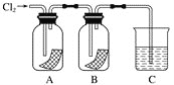
(1)通氯气一段时间后,A中观察到的现象是______________________________,B中观察到的现象是_________________,由此可得出的结论是____________________________,写出有关反应的化学方程式:____________________。
(2)C装置的作用是____________________,理由是_______________________________,写出有关反应的化学方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五水硫酸铜(CuSO4·5H2O)和六水硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]都是重要的化工原料,用途十分广泛。
请回答与这两种物质中元素有关的一些问题。
(1)基态铁原子的核外电子排布式为_______;基态铜原子的电子占据的最高能层符号为_______ 。
(2)氧元素的第一电离能小于氮元素,其原因是_______ 。
(3)SO42-、H2O、NH4+三种微粒中,空间构型为正四面体的是_______;NH4+中氮原子的杂化轨道类型是_______。
(4)写出与SO42-互为等电子体的分子的化学式_______ (写一种)。
(5)Cu与Au的合金可形成面心立方最密堆积的晶体,在该晶胞中Cu原子处于面心,该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为_______,若该晶体的密度为ρg.cm-3,则晶胞中Cu原子与Au原子中心的最短距离d=_______cm(NA表示阿伏加德罗常数的值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示的转化关系以及现象回答下列问题。
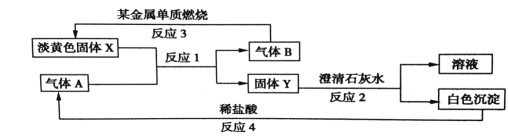
(1)固体 X的化学式是:________________
(2)写出反应1 的化学方程式:____________________________
(3)写出反应2 的离子方程式:________________________________
(4)若15.6gX 和足量的气体 A反应,转移__________mol 电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定有三种途径:生物固氮、自然固氮和工业固氮。根据最新“人工固氮”的研究报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分平衡时实验数据见下表(光照、N2压力1.0×105Pa、反应时间1 h):
T/K | 303 | 313 | 323 | 353 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
相应的化学方程式:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) ΔH=a kJ·mol-1
4NH3(g)+3O2(g) ΔH=a kJ·mol-1
回答下列问题:
(1)此合成反应的a________0;(填“>”、“<”或“=”)
(2)从323 K到353 K,氨气的生成量减少的可能原因是_______________________________;(3)与目前广泛使用的工业合成氨方法相比,该方法固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议__________________________________________________。
(4)工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,分别研究在T1、T2和T3(T1<T2<T3)三种温度下合成氨气的规律。下图是上述三种温度下不同的H2和N2的起始组成比(起始时N2的物质的量均为1 mol)与N2平衡转化率的关系。请回答:
2NH3(g) ΔH=-92.4 kJ·mol-1,分别研究在T1、T2和T3(T1<T2<T3)三种温度下合成氨气的规律。下图是上述三种温度下不同的H2和N2的起始组成比(起始时N2的物质的量均为1 mol)与N2平衡转化率的关系。请回答:

①在上述三种温度中,曲线X对应的温度是________。
②a、b、c三点中H2的转化率最小的是_______点、转化率最大的是________点。
③在容积为1.0 L的密闭容器中充入0.30 mol N2(g)和0.80 molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。该条件下反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数为__________________。
N2(g)+3H2(g)的平衡常数为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏伽德罗常数的数值为,下列叙述正确的是( )
A.标准状况下,22.4L四氯化碳含有的分子数为NA
B.1 mol硫酸钾中阴离子所带的电荷数为2NA
C.0.5 molL﹣1NaOH溶液中 Na+数为0.5NA
D.常温常压下,16g氧气所含电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是目前国际上公认的高效、广谱、快速安全的杀菌剂。工业制ClO2的化学反应为2NaClO3 + SO2 + H2SO4=2ClO2 + 2NaHSO4。下列有关该反应的说法正确的是
A. SO2是氧化剂 B. NaClO3被氧化
C. SO2发生了还原反应 D. NaClO3得到电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com