

| A、①中液体为FeCl3溶液 |
| B、②中液体为酒精 |
| C、③中液体为H2SO4溶液 |
| D、④中液体为稀盐酸 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、0.2 mol/(L?s) |
| B、0.4 mol/(L?s) |
| C、0.6 mol/(L?s) |
| D、0.8 mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2 mol/L |
| B、0.5 mol/L |
| C、0.1 mol/L |
| D、0.05 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氟氯烃是一类含氟和氯原子的卤代烃 |
| B、1-丁烯存在顺反异构 |
| C、1mol甲烷可与2mol Cl2完全取代生成CCl4 |
D、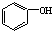 的结构中含有决定醇类性质的官能团--羟基 的结构中含有决定醇类性质的官能团--羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应中生成了22.4L CO |
| B、反应中有12g碳被还原 |
| C、有0.5mol SiO2参加反应 |
| D、反应中有0.5×6.02×1023个电子发生转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、凡是含碳元素的化合物都属于有机物 |
| B、易溶于汽油、酒精、苯等有机溶剂中的物质一定是有机物 |
| C、所有的有机物都很容易燃烧 |
| D、有机物不一定都不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl溶液、CO2 |
| B、铜、蔗糖 |
| C、液态HCl、NH3 |
| D、汽油、硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | ⑤ |
| 0.1mol?L-1 CH3COOH溶液 | 0.01mol?L-1 CH3COOH溶液 | pH=2 CH3COOH溶液 |
0.1mol?L-1 NaOH溶液 |
0.1mol?L-1 氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
1 1 |
2 1 |
3 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com