
【题目】MnSO4在工业中有重要应用,用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4,其过程如下:


【资料】部分阳离子形成氢氧化物沉淀的pH
离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
开始沉淀时的pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
完全沉淀时的pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
(1)向软锰矿浆中通入SO2生成MnSO4,该反应的化学方程是___________。
(2)加入MnO2的主要目的是___________;
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调至____范围,生成的沉淀主要含有____和少量CaSO4。
(4) 阳离子吸附剂可用于主要除去的离子是______________。
(5) 用惰性电极电解MnSO4溶液,可以制得高活性MnO2。电解MnSO4、ZnSO4和H2SO4的混合溶液可制备MnO2和Zn,写出阳极的电极反应方程式________________。
【答案】 SO2+MnO2=MnSO4 将Fe2+氧化为Fe3+ 4.7≤pH<8.3 Fe(OH)3、Al(OH)3 Ca2+、Pb2+ Mn2+2e+2H2O=MnO2↓+4H+
【解析】软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)通入SO2得到浸出液,MnO2与SO2发生氧化还原反应,其中的金属离子主要是Mn2+,浸出液还含有少量的Fe2+、Al3+等其他金属离子,Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+,在氧化后的液体中加入石灰浆,杂质中含有Fe2+、Al3+、Ca2+、Pb2+四种阳离子,由沉淀的pH范围知,Fe3+、Al3+阳离子通过调pH值,转化为氢氧化铁、氢氧化铝沉淀,加入阳离子吸附剂,除去Ca2+、Pb2+,过滤,滤液蒸发浓缩,冷却结晶,获得MnSO4晶体。
(1)I中向软锰矿浆中通入SO2生成MnSO4,MnO2与SO2发生氧化还原反应的化学方程式为SO2+MnO2=MnSO4;故答案为:SO2+MnO2=MnSO4;
(2)杂质离子中Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+,故答案为:将Fe2+氧化为Fe3+;
(3)杂质中含有Fe3+、Al3+阳离子,从图可表以看出,大于4.7可以将Fe3+和Al3+除去,小于8.3是防止Mn2+也沉淀,所以只要调节pH值在4.7~8.3间即可,Fe3+、Al3+转化为氢氧化铁、氢氧化铝沉淀,故生成的沉淀主要为Fe(OH)3、Al(OH)3和少量CaSO4;故答案为:4.7≤pH<8.3; Fe(OH)3、Al(OH)3;
(4)从吸附率的图可以看出,Ca2+、Pb2+的吸附率较高,故答案为:Pb2+、Ca2+;
(5)电解MnSO4、ZnSO4和H2SO4的混合溶液可制备MnO2和Zn,阳极上是发生氧化反应,元素化合价升高为MnSO4失电子生成MnO2,ZnSO4反应得到电子生成Zn,阳极电极反应为:Mn2+-2e-+2H2O=MnO2↓+4H+,故答案为:Mn2+-2e-+2H2O=MnO2↓+4H+。


科目:高中化学 来源: 题型:
【题目】下列有关物质性质的比较,结论正确的是
A. 碱性:LiOH<RbOH
B. 溶解度:Na2CO3<NaHCO3
C. 热稳定性:PH3<SiH4
D. 沸点:C2H5OH<C2H5SH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热、搅拌和仪器固定装置均已略去):实验过程如图1:

①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃90℃,保持30min, 然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入二颈烧瓶中;
③控制反应液温度在5560℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸 (65%HNO3与98%H2SO4的质量比为 2: 1.5)溶液;
④反应3h左右,冷却,减压过滤后得草酸晶体粗品,再重结晶得草酸晶体。硝酸氧化淀粉水解液过程中可发生下列反应:
⑤C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1) 实验①加入98%硫酸少许的目的是:____________。
(2) 实验中若混酸滴加过快,将导致草酸产量下降,其原因是____________。
(3) 装置B的作用是________,为使尾气充分吸收,C中试剂是____________。
(4) 重结晶时,将草酸晶体粗品经①加热溶解、②趁热过滤、③冷却结晶、④过滤洗涤、⑤干燥等实验步骤,得到较纯净的草酸晶体。该过程中可将粗品中溶解度较大的杂质在_____(填上述步骤序号)时除去;
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。
用酸性KMnO4标准溶液滴定,该反应的离子方程式为:____________,称取该样品加适量水完全溶解,然后用0.02000mol/L的酸性KMnO4溶液滴定至终点(杂质不参与反应),滴定前后滴定管中的液面读数如图2,则消耗KMnO4溶液的体积为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氢气和碳燃烧的热化学方程式为:
①2H2(g)+O2(g)=2H2O(l) △H1=-akJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) △H2=-bkJ·mol-1
③C(s)+1/2O2(g)=CO(g) △H3=-ckJ·mol-1
④C(s)+O2(g)=CO2(g) △H4=-dkJ·mol-1
下列说法错误的是
A. 氢气的燃烧热为△H=-akJ·mol-1
B. c<d
C. 一氧化碳的燃烧热为△H=-(d-c)kJ·mol-1
D. 0.5a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物PAS-Na是一种治疗肺结核药物的有效成分,有机物G是一种食用香料,以甲苯为原料合成这两种物质的路线如下:

已知:

冋答下列问题:
(1) F中含氧官能团的名称是_______;
(2) 质谱图显示试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,写出肉桂酸与试剂b生成G的化学方程式:___________________。
(3) 当试剂d过量时,可以选用的试剂d是______(填字母序号)。
a. NaHCO3 b. NaOH c. Na2CO3 d. Na
(4) 写出C与NaOH反应的化学方程式________________。
(5)肉桂酸有多种同分异构体,符合下列条件的有______种。
a.苯环上有三个取代基;
b.能发生银镜反应,且1mol该有机物场多生成4mol Ag.
由上述符合条件的同分异构体中,写出苯环上有两种不同化学环境氢原子的有机物的结构简式(任写一种即可)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的说法正确的是
A. 任何非金属单质分子中一定含有共价键
B. 离子化合物中可能存在共价键,共价化合物中也可能存在离子键
C. 离子化合物中可能存在共价键,但共价化合物中一定不存在离子键
D. MgF2中既含有离子键又含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容的密闭容器中,混合气体A、B、C 的物质的量浓度(c)与时间(t) 的关系如下表所示:
t c | 初始 | 2min | 4min | 6min | 8min |
c(A)( mol·L -1) | 2.50 | 2.20 | 2.00 | 2.00 | 2.20 |
c(B)( mol·L -1) | 1.56 | 2.16 | 2.56 | 2.56 | 2.16 |
c(C)( mol·L -1) | 0.39 | 0.54 | 0.64 | 0.64 | 1.54 |
请填空:
(1)前2 min内,v(B)= _______________________。
(2) 到2 min末A 的转化率为_________________。
(3)该反应的化学方程式为_______________________________________。
(4)6 min - 8 min若只改变了反应体系中某一种物质的浓度,则应为_____(填选项字母)
a.增大A的浓度 b.减小B的浓度 c.增大C的浓度
则该物质的浓度改变量为________________mol·L -1
(5)如果在相同条件下,若开始加入的三种物质的物质的量浓度是原来的2倍,则_____是原来的2倍。
a. B的平衡浓度 b. 达到平衡的时间 c. 平衡时气体的密度 d. 平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废料中主要含有Al2O3、Co2O3CoO、少量Fe3O4等金属氧化物(Co2O3CoO不与强碱反应).实验室科技人员欲将之分离并制备相关物质,设计流程如下: 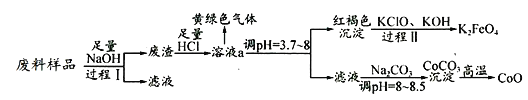
(1)过程Ⅰ中的操作名称是__,写出过程Ⅰ发生反应的化学方程式____________.
(2)溶液a中含有金属离子有 _________________.
(3)溶液a中逸出的黄绿色气体是氯气,下列说法不正确的是_________.
①氯气是有漂白性的酸性气体
②液氯和氯水均为液体,且都含有氯分子
③将氯气通入碱液时,氯气既是氧化剂,又是还原剂
④次氯酸见光易分解,说明次氯酸是弱酸
⑤向氯水中滴硝酸银溶液,有白色沉淀生成,说明氯水中含Cl-
(4)写出过程Ⅱ发生反应的离子方程式:_______________________________.
高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
则充电时阳极反应式为___________________________________.
(5)Co可以形成CoC2O42H2O(M为183g/mol),5.49g该晶体在空气中加热,在不同温度下分别得到一种固体物质,其质量如表:
温度范围(℃) | 固体质量(g) |
150﹣210 | 4.41 |
290﹣320 | 2.41 |
890﹣920 | 2.25 |
经测定,210℃~290℃过程中,产生的气体只有CO2,则此过程发生的化学反应方程式为:______________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com