
某无色溶液X,由Na+、Ag+、Ba2+、Al3+、[Al(OH)4]--、 MnO4—、CO32-- 、SO42—中的若干种离子组合,取溶液进行如下连续试验:(填化学用语)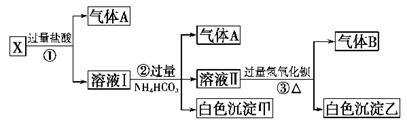
(1)气体A的成分是:_________________,气体B的成分是_____________
(2)X溶液中一定存在的离子是:____________________________
(3)写出步骤①发生反应的所有离子反应方程式:_________________________
(4)写出步骤②形成白色沉淀甲的离子方程式:______________________
(5)写出白色沉淀乙的可能组成:____________________________
(1)CO2 NH3 (2)CO32-、 AlO2- 、 Na+
(3)CO32-+2H+=H2O+CO2↑ [Al(OH)4]-+4H+=Al3++4H2O
(4)Al3++3HCO3-=Al(OH)3↓+3CO2↑ ;(5)一定存在BaCO3,可能有BaSO4
解析试题分析:(1)无色溶液中不可能含有紫色的MnO4—;向X中加入HCl,产生气体A是CO2,则说明原来的溶液中含有CO32--,由于CO32—与Ba2+、Ag+会发生离子反应而不能电离共存,而没有产生沉淀,说明不含Ag+、Ba2+;CO32—与Al3+会发生双水解反应液不能大量共存,因此也不含有Al3+;向溶液I中加入过量的NH4HCO3溶液,既有气体产生,何有白色沉淀产生,说明发生了双水解反应,则原溶液中含有[Al(OH)4]-(或AlO2-),产生的沉淀是Al(OH)3,气体是CO2;再向溶液中加入过量的Ba(OH)2溶液,产生气体B是氨气,由于②中加入了过量的NH4HCO3溶液,所以白色沉淀乙一定含有BaCO3;若原溶液中含有SO42—,则沉淀中还会含有BaSO4。由于溶液呈电中性,含有的CO32-和 AlO2-都是阴离子,而阳离子Ag+、Ba2+、Al3+都不存在,所以一定还含有Na+;(1)气体A的成分是CO2;气体B的成分是NH3;(2)根据上述分析可知在X溶液中一定存在的离子是:CO32-、 AlO2-、Na+;一定不含的离子是Ag+、Ba2+、Al3+、MnO4—;可能含有的离子是SO42—。(3)步骤①发生反应的所有离子反应方程式是CO32-+2H+=H2O+CO2↑;[Al(OH)4]-+4H+=Al3++4H2O;(4)写出步骤②形成白色沉淀甲的离子方程式是Al3++3HCO3-=Al(OH)3↓+3CO2↑;(5)白色沉淀乙中一定存在BaCO3,可能有BaSO4。
考点:考查溶液成分的确定、离子共存、盐的水解、气体的确定、离子方程式的书写的知识。


科目:高中化学 来源: 题型:单选题
下列表示对应反应的离子方程式正确的是
A.用惰性电极电解氯化镁溶液:2Cl-+2H+ H2↑+Cl2↑ H2↑+Cl2↑ |
| B.亚硫酸钠溶液中投入Na2O2: SO32-+2Na2O2=SO42-+O2↑+4Na+ |
| C.Fe2O3溶于足量的氢碘酸溶液中:Fe2O3+6H+=2Fe3++3H2O |
| D.鸡蛋壳和醋酸溶液的主要反应:CaCO3+2CH3COOH=2CH3COO-+Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)某固体混合物可能由KNO3、K2SO4、KI、KCl、NaCl、CuCl2、CaCl2和Na2CO3中的一种或几种组成。依次进行下列五步实验,观察到的现象记录如下:
(1)混合物加水得无色透明溶液;
(2)向上述溶液中滴加BaCl2溶液,有白色沉淀生成。将该沉淀滤出,并将滤液分成两份;
(3)上述白色沉淀可完全溶于稀盐酸;
(4)将两份滤液中的一份,滴加氯水并加入CCl4,振荡后静置,CCl4层无色;
(5)将另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸。
根据以上实验,可以判断出混合物中①肯定含有_______,②不能确定是否含有 _________,③一定不含有_______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下: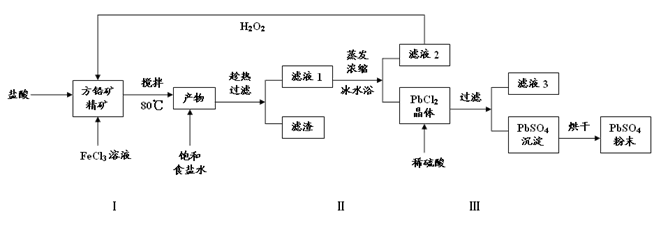
已知:(ⅰ)PbCl2(s)+2Cl-(aq) PbCl4-(aq) △H>0
PbCl4-(aq) △H>0
(ⅱ)Ksp(PbSO4)=1.08×10-8, Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的PH值分别为3.2、7.04
(1)步骤Ⅰ中生成PbCl2和S的离子方程式 ,加入盐酸的另一个目的是为了控制PH值在0.5~1.0,原因是 。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因 。
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式 。
(4)请用离子方程式解释滤液2加入H2O2可循环利用的原因 ,滤液3是 。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的 PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)湿法炼锌的冶炼过程可用下图简略表示: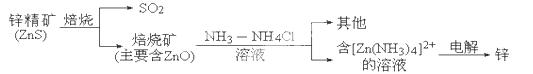
请回答下列问题:
(1)已知:N2(g)+2H2(g)===N2H4(l) ΔH=a kJ·mol-1,该反应不能自发进行,则a 0(填“>”、“<”或“=”).
(2)ZnS焙烧的反应2ZnS+3O2 2SO2+2ZnO所涉及的物质中,发生氧化反应的物质是 ,不含离子键的化合物是 .
2SO2+2ZnO所涉及的物质中,发生氧化反应的物质是 ,不含离子键的化合物是 .
(3)电解过程中析出锌的电极反应式为___________________________.
(4)产生的SO2可用Ba(NO3)2溶液吸收,部分产物可作为工业原料,其反应的离子方程式为 .
(5)锌-空气电池与锂电池相比,具有储存电量高、成本低、没有安全隐患等优点。该电池的总反应为2Zn+O2===2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为 。25℃时,以该电池为电源,用两个等质量的铜棒作电极电解500 mL 0.1mol/L CuSO4溶液,一段时间后切断电源,对电极干燥并称量,测得两电极的质量差为9.6 g,则至少需要________L空气(折算成标准状况)进入该电池。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学–选修2:化学与技术】(15分)
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O),是重要的化工产品和强氧化剂。工业制备红矾钠的流程如下: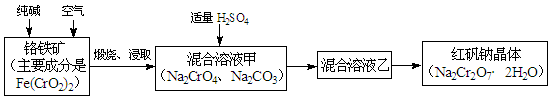
(1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成 。
(2)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:4Fe(CrO2)2+8Na2CO3+7O2 = 2Fe2O3+8Na2CrO4+8CO2。为了加快该反应的反应速率,可采取的措施是 。(写一种即可)
(3)已知CrO42-在不同的酸性溶液中有不同的反应,如:
2CrO42-+2H+= Cr2O72-+H2O; 3CrO42-+4H+= Cr3O102-+2H2O
① 往混合溶液甲中加入硫酸必须适量的原因是 。
② 混合溶液乙中溶质的化学式是 。
(4)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O 2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
(5)请配平碱性溶液还原法中发生的离子反应:
□Cr2O72-+□S2-+□H2O ——□Cr(OH)3+□S2O32-+□OH-
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
黄铜矿主要成分是二硫化亚铁铜(CuFeS2)。黄铜矿经熔炼、煅烧后得到粗铜和炉渣,冶炼过程的主要反应有: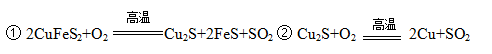
(1)二硫化亚铁铜也可以表示为CuS·FeS,其中硫元素的化合价是 。
(2)反应②中还原剂是 。
(3)某校学习小组用炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制备铁红,进行如下实验。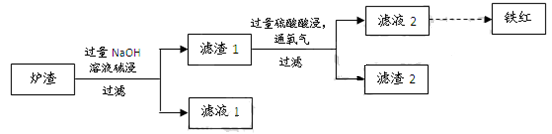
① 炉渣碱浸时反应的离子方程式是 、 。
② 滤渣1中加入硫酸并通入氧气可使FeO转化为Fe3+,该反应的离子方程式是 ;为检验铁元素是否被氧化完全,应进行的实验是:取少量滤液2于试管中 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式: 。
(2)下列三种情况下,离子方程式与 (1)相同的是 (填序号)。
A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用如图中的 (填序号)曲线表示。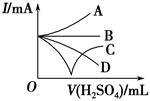
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示。向该烧杯中缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将 。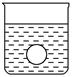
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某工厂用软锰矿(含MnO2约70%及Al2 O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2,和Zn(干电池原料)。流程如下: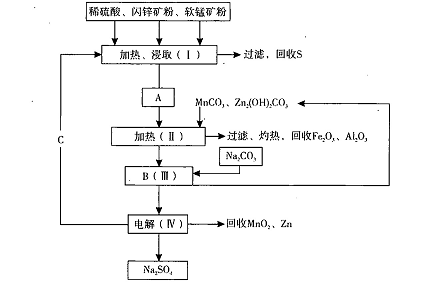
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3,Al2(SO4)3的混合液。
②IV中的电解反应式为MnSO4+ZnSO4+2H2O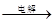 MnO2+Zn +2H2SO4。
MnO2+Zn +2H2SO4。
(1)A中属于还原产物的是 。
(2)加入MnCO3、Zn2(OH)2CO3的作用是 :C的化学式是 。
(3)该生产中除得到Na2SO4、S等副产品外,还可得到的副产品是 。
(4)副产品S可用于制硫酸,转化过程是:S→SO2→SO3→H2SO4。写出第二步转化的化学方程式 。
(5)要从Na2SO4溶液中得到芒硝( Na2SO4.10H2O),需进行的操作有蒸发浓缩、 、
过滤、洗涤、干燥等。
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿投料的质量比大约是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com