
| A.Fe3+不与I-发生反应 |
| B.Fe3+与F-结合成不与I-反应的物质 |
| C.F-使I-的还原性减弱 |
| D.Fe3+被F-还原为Fe2+,使溶液中不再存在Fe3+ |
科目:高中化学 来源:不详 题型:单选题
| A.8.8 g | B.9.2g | C.8 g | D.16 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应后生成的盐只为Fe(NO3)3 |
| B.反应后生成的盐只为Fe(NO3)2 |
| C.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1∶3 |
| D.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为3∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
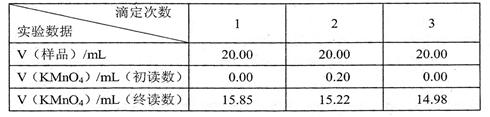
 [实验记录]
[实验记录] 2)本实验所用的KMnO4标准溶液的物质的量浓度为
2)本实验所用的KMnO4标准溶液的物质的量浓度为  。
。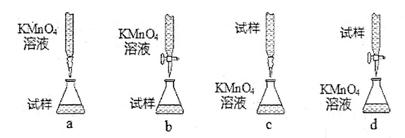
 洗一下,再继续滴定至终点,则所测得的补血剂中铁元素的含量 (偏大、偏小、无影响)。
洗一下,再继续滴定至终点,则所测得的补血剂中铁元素的含量 (偏大、偏小、无影响)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu、Fe3+ | B.Fe2+、Fe3+ |
| C.Cu、Cu2+、Fe | D.Cu、Fe2+、Fe |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
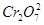 )废水用硫酸亚铁铵[
)废水用硫酸亚铁铵[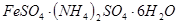 ]处理,反应中铁元素和铬元素
]处理,反应中铁元素和铬元素 完全转化为沉淀,该沉淀干燥后得到
完全转化为沉淀,该沉淀干燥后得到 ,不考虑处理过程中的实际损耗,下列叙述错误的是
,不考虑处理过程中的实际损耗,下列叙述错误的是A.消耗硫酸亚铁铵的物质的量为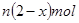 |
B.处理废水中的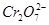 的物质的量为 的物质的量为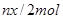 |
C.反应中发 生转移的电子数为 生转移的电子数为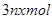 |
D.在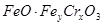 当中 当中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
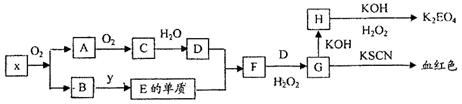
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 白的副产品绿矾制备还原铁粉的工业流程如下:
白的副产品绿矾制备还原铁粉的工业流程如下: 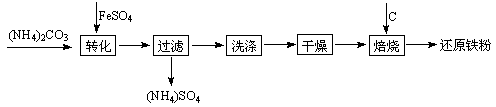
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com