
【题目】
离子 | K+ | Na+ | Mg2+ | Ca2+ | NO3 | H2PO4- | SO42- | Zn2+ |
培养液浓度(mol/L) | 1 | 1 | 0.35 | 1 | 2 | 1 | 0.25 | 1 |
A.Ca2+B.SO42-C.Zn2+D.H2PO4
科目:高中化学 来源: 题型:
【题目】碳化硅(SiC)陶瓷基复合材料是一种新型热结构材料。在空气中,碳化硅能与熔融的氢氧化钠发生反应:SiC+2NaOH+2O2=Na2SiO3+X+H2O,下列有关X物质的化学式推断中,正确的是( )
A.SiO2 B.CO C.CO2 D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验需要0.80 mol·L-1NaOH溶液475 mL和0.40 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
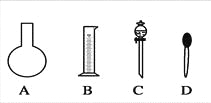
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)下列操作中,不能用容量瓶实现的有______________(填序号)。
A.配制一定体积准确浓度的标准溶液 |
B.量取一定体积的液体 |
C.测量容量瓶规格以下的任意体积的液体 |
D.准确稀释某一浓度的溶液 |
E.贮存溶液
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为___________g。在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度_________(填”大于”、“等于”或“小于”,下同)0.8 mol·L-1。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度__________0.8 mol·L-1。
(4)根据计算得知,所需质量分数为98 %、密度为1.84 mol·L-1的浓硫酸的体积为__________mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL、50 mL量筒,选用___________mL量筒最好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个温度和体积不变的容器中,硫可以发生如下变化,其反应过程和能量关系如图1所示。(SO2(g)+1/2O2(g)![]() SO3(g) △H=-98.45kJ·mol-1)
SO3(g) △H=-98.45kJ·mol-1)
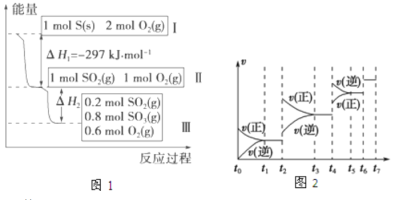
(1)硫燃烧的热化学方程式为 。
(2)恒容条件下,下列措施中能使n(SO3)/n(SO2)比图1所示情况增大的有 。
A.降低温度 B.充入He C.再充入1mol SO2(g)和1mol O2(g) D.使用催化剂
(3)恒温恒容时,图1中II到III反应放出的热量比1mol SO2和2mol O2充分反应放出的热量 (填
“大”、“小”或“相等”)。
(4)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t2时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是 。(如t1~t2、t3~t4、t5~t6、t6~t7等)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用H2可将工业废气中的NO催化还原成N2,其他量转化关系如图(图中计量单位为mol), 则:NO(g)+H2(g)=![]() N2(g)+H2O(g)的△H为( )
N2(g)+H2O(g)的△H为( )
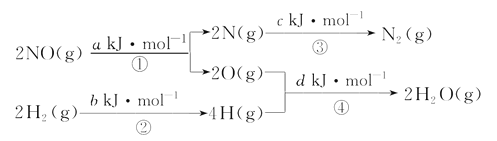
A.0.5(a+b-c-d)kJ/mol B.0.5(c+a-d-b)kJ/mol
C.0.5(c+d-a-b)kJ/mol D. 0.5(c+d-a-b)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素有三种核素16O、17O、18O,它们在自然界中所占的原子个数百分比分别为a%、b%、c%,则下列说法正确的是
A. 一个16O原子的质量为16 g
B. 17O的相对原子质量约为17
C. 氧元素的相对原子质量为![]()
D. 氧元素的相对原子质量为(16a%+17b%+18c%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是 ( )
A.工业上粗硅的制备:SiO2+C![]() Si+CO2↑
Si+CO2↑
B.Cu2O与稀H2SO4反应:Cu2O+2H+=2Cu++H2O
C.用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO3-=3Ag++NO↑+2H2O
D.向Mg(HCO3)2溶液中加足量烧碱溶液:Mg2++2HCO3-+2OH-=MgCO3↓+2H2O+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新生活方式。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ/mol
Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489.0 kJ/mol
则CO还原Fe2O3的热化学方程式为 ;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO。PdCl2被还原成单质,反应的化学方程式为 ;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池。
①负极电极反应式是 ;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 。(填序号)
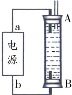
A.电源中的a为正极,b为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有Cl2的六个集气瓶甲、乙、丙、丁、戊、己中各注入下列液体中的一种,经过振荡,现象如下图所示,则甲、乙、丙、丁、戊、己注入的液体分别是( )
①AgNO3溶液 ②NaOH溶液 ③水 ④淀粉-KI溶液 ⑤FeCl2与KSCN混合液 ⑥NaBr溶液
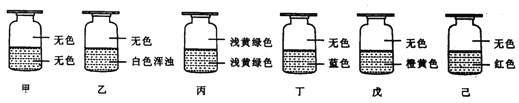
A.④①②⑥⑤③ B.⑥①③④②⑤ C.⑥③②④①⑤ D.②①③④⑥⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com