
【题目】在密闭容器中进行A(g)+2B(s)![]() 2C(s)+3D(s) ΔH>0的反应,下列说法正确的是( )
2C(s)+3D(s) ΔH>0的反应,下列说法正确的是( )
A. 升高温度,正反应速率增大,逆反应速率减小
B. 容器内气体平均相对分子质量不变时达到化学平衡状态
C. 温度不变,增大B的投入量,正反应速率增大
D. 温度不变,压缩容器体积重新达到平衡后,A的浓度不变
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氮化铬(CrN)是一种良好的耐磨材料,实验室可用无水氯化铬(CrCl3)与氨气在高温下反应制备,反应原理为CrCl3+NH3![]() CrN+3HCl.回答下列问题:
CrN+3HCl.回答下列问题:
(1)制备无水氯化铬。氯化铬有很强的吸水性,通常以氯化铬晶体(CrCl3·6H2O)的形式存在。直接加热脱水往往得到Cr2O3,有关反应的化学方程式为______________,以氯化铬晶体制备无水氯化铬的方法是_____________________________。
(2)制备氮化铬。某实验小组设计制备氮化铬的装置如下图所示(夹持与加热装置省略):
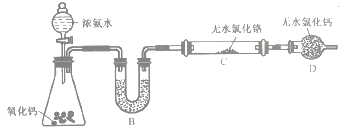
①装置A中发生反应的化学方程式为_____________________。
②实验开始时,要先打开装置A中活塞,后加热装置C,目的是___________________。
③装置B中盛放的试剂是____________,装置D的作用是_____________________。
④有同学认为该装置有一个缺陷,该缺陷是_______________________。
(3)氯化铬的纯度测定。制得的CrN中含有Cr2N杂质,取样品14.38g在空气中充分加热,得固体残渣(Cr2O3)的质量为16.72g,则样品中CrN的质量分数为_____________(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质物质的量都为1mol,完全燃烧生成二氧化碳和水所消耗相同条件下氧气的量最多的是
A. CH4B. CH3CHOC. C2H5OHD. CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某些有机物之间的相互转化可以储存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)。已知: ①C7H8(l)(NBD)+9O2(g)=7CO2(g)+4H2O(l) ΔH1,②C7H8(l)(Q)+9O2(g)=7CO2(g)+4H2O(l) ΔH2,③
![]()
![]() ΔH=+88.62 kJ·mol-1。下列叙述不正确的是( )
ΔH=+88.62 kJ·mol-1。下列叙述不正确的是( )
A. ΔH1>ΔH2 B. NBD的能量比Q的能量高
C. NBD比Q稳定 D. NBD转化为Q是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4,SiCl4经提纯后用氢气还原得高纯度硅。以下是实验室制备SiCl4的装置示意图。
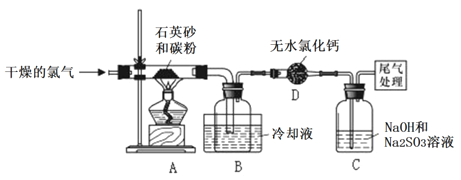
请回答下列问题:
(1)仪器D的名称_____________。
(2)装置A的硬质玻璃管中发生反应的化学方程式是________________。
(3)C中吸收尾气一段时间后,吸收液中存在多种阴离子,下列有关吸收液中离子检验的说法正确的是_____。
A.取少量吸收液加入AgNO3溶液,若生成白色沉淀,则说明一定存在Cl-
B.取少量吸收液,滴加溴水,若溴水褪色,则说明一定存在SO32-
C.取少量吸收液,加过量BaCl2溶液,过滤出沉淀,向沉淀中加过量稀盐酸,若沉淀部分溶解,且有气泡产生,则说明一定存在SO32-
D.取少量吸收液,加硫酸酸化后再加淀粉碘化钾溶液,若溶液变蓝,则说明一定存在ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 4NH3+5O2![]() 4NO+6H2O 在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率
4NO+6H2O 在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率![]() x(
x(![]() x表示反应物的消耗速率或生成物的生成速率)为 ( )
x表示反应物的消耗速率或生成物的生成速率)为 ( )
A. ![]() (NH3)= 0.002mol/(L·s) B.
(NH3)= 0.002mol/(L·s) B. ![]() (O2)= 0.01mol/(L·s)
(O2)= 0.01mol/(L·s)
C. ![]() (NO)= 0.008mol/(L·s) D.
(NO)= 0.008mol/(L·s) D. ![]() (H2O)= 0.004mol/(L·s)
(H2O)= 0.004mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业的原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
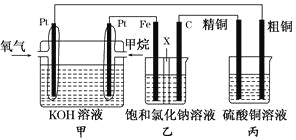
(1)甲烷燃料电池负极反应式为________________________。
(2)石墨(C)极的电极反应式为_______________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成的气体的体积为________L;丙装置中阴极析出铜的质量为________ g。
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。
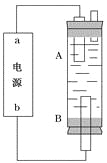
若用于制漂白液,a为电池的________极,电解质溶液最好用)________________
若用于制Fe(OH)2,使用硫酸钠溶液作电解质溶液,阳极选用________作电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ①根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题:
该反应中氧化剂是______________,氧化产物是___________________。
②在方程式中用双线桥法表示出反应中的电子转移:_____________
8NH3+3Cl2=6NH4Cl+N2
Ⅱ.配平下列化学方程式或离子方程式,填写相关空白
①______KClO3+ ______HC1--_____KCl+ ______Cl2↑+ ______H2O
生成3 mol Cl2时转移电子的物质的量为______.
②______MnO4-+______SO2 +_____ _______=______Mn2++ ______SO42-+____ _____
氧化剂与氧化产物的物质的量之比是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁—空气电池是最常见也是最常用的一种镁燃料电池,电池构造如图所示,下列说法不正确的是

A.电池工作时![]() 、
、![]() 向两侧移动
向两侧移动
B.电池总反应是:![]()
C.该电池因存在![]() 副反应,导致性能降低
副反应,导致性能降低
D.多孔石墨电极反应式为:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com