
| 催化剂 |


| 催化剂 |
| 催化剂 |
| c(N2)?c2(CO2) |
| c2(NO)?c2(CO) |
| c(N2)?c2(CO2) |
| c2(NO)?c2(CO) |
| ||
| 0.1mol |
| 0.1L |
| 1×10-14 |
| 1 |


科目:高中化学 来源: 题型:
| A、D2O中质子数与中子数 |
| B、Na2O2中的阴,阳离子数 |
| C、SO2与氯水反应生成两种强酸的反应中,氧化剂与还原剂 |
| D、沸水时纯水中H+与OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 a、b、c、d、e是含有一种相同元素的五种物质,可发生如右图所示的转化.其中:a是单质;c、d是氧化物;e是最高价氧化物对应的水化物.
a、b、c、d、e是含有一种相同元素的五种物质,可发生如右图所示的转化.其中:a是单质;c、d是氧化物;e是最高价氧化物对应的水化物.查看答案和解析>>
科目:高中化学 来源: 题型:
 C在一定条件下可发生反应,生成一种高分子化合物E,E的结构简式为
C在一定条件下可发生反应,生成一种高分子化合物E,E的结构简式为 ,其中R、R′为烃基.请回答以下问题:
,其中R、R′为烃基.请回答以下问题: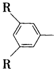 ,且属于酯的所有同分异构体的结构简式
,且属于酯的所有同分异构体的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、反应①是加成反应 |
| B、反应②是加聚反应 |
| C、反应③是消去反应 |
| D、反应④⑤⑥是取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com