
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | Si有导电性 | Si可用于制备光导纤维 |
| B | Fe的金属活动性大于Cu | FeCl3溶液可用于回收废旧电路板中的铜 |
| C | Na2O2与水反应能生成碱 | Na2O2属于碱性氧化物 |
| D | 次氯酸光照易分解 | 新制氯水保存在棕色试剂瓶中,放于冷暗处 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.制造光导纤维主要成分为二氧化硅;
B.依据氧化剂氧化性强于氧化产物氧化性;
C.碱性氧化物与水反应只生成氢氧化钠;
D.次氯酸见光分解,见光易分解的物质应保存在棕色瓶.
解答 解:A.制造光导纤维主要成分为二氧化硅,Ⅱ错误,故A错误;
B.FeCl3溶液可用于回收废旧电路板中的铜,是因为三价铁离子氧化性强于铜离子,与金属活泼性无关,故B错误;
C.过氧化钠与水反应生成氢氧化钠和氧气,不符合碱性氧化物概念,故C错误;
D.次氯酸见光分解,见光易分解的物质应保存在棕色瓶,所以新制氯水保存在棕色试剂瓶中,放于冷暗处,故D正确;
故选:D.
点评 本题考查了元素化合物知识,熟悉硅、二氧化硅、次氯酸物质的性质是解题关键,注意碱性氧化物的概念,题目难度不大.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:填空题
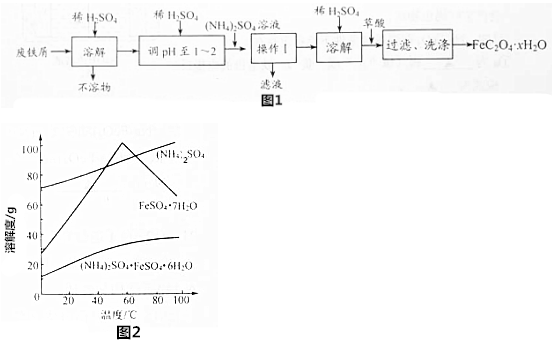
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
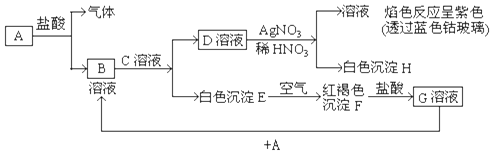
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌与镁 | B. | 铁与锌 | C. | 铝与铁 | D. | 镁与铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将饱和FeCl3溶液滴入到NaOH溶液中加热煮沸可制得Fe(OH)3胶体 | |
| B. | 可用Na从TiCl4的水溶液中生产Ti | |
| C. | 工业上利用氯气和石灰水反应生产漂白粉和漂粉精 | |
| D. | 可用石英、石灰石、纯碱在高温下生产玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②③⑥ | C. | ④⑤⑥ | D. | ②⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为 890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30MPa 下,将 0.5mol N2和 1.5molH2置于密闭容器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为:N2+3H2(g)$?_{500℃,30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 稀盐酸和 稀氢氧化钠溶液混合,其热化学方程式为:H+(aq)+OH-(aq)=H2O(1)△H=-57.3 kJ•mol-1 | |
| D. | 1molH2完全燃烧放热 142.9kJ,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(1)△H=+285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该合金中铝的物质的量为 0.2mol | B. | 该合金中镁的物质的量为 2.4g | ||
| C. | 盐酸的物质的量浓度为 4mol/L | D. | 该反应中转移的电子数为0.4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com