
分析 (1)将纯碱逐滴加入到盐酸中,发生反应为:Na2CO3+2HCl═2NaCl+H2O+CO2↑,根据反应方程式计算二氧化碳的体积;
(2)将盐酸逐滴加入到纯碱溶液中,发生反应为:Na2CO3+HCl═NaCl+NaHCO3,NaHCO3+HCl═NaCl+H2O+CO2↑,根据反应方程式计算二氧化碳的体积.
解答 解:(1)将纯碱逐滴加入到盐酸中,发生反应为:
Na2CO3+2HCl═2NaCl+H2O+CO2↑,
1mol 2mol 22.4L
1mol 1.25mol V(CO2)
盐酸不足,根据盐酸求二氧化碳的体积,所以V(CO2)=$\frac{22.4×1.25}{2}$=14L,
答:将A逐滴加入到B中产生的CO2在标准状况下的体积为14L;
(2)将盐酸逐滴加入到纯碱溶液中,发生反应为:
Na2CO3 +HCl═NaCl+NaHCO3,
1mol 1.25mol 1mol
NaHCO3 +HCl═NaCl+H2O+CO2↑
1mol 0.25mol 0.25mol
所以此时V(CO2)=0.25mol×22.4L/mol=5.6L,
答:将B逐滴加入A中,生成CO2气体为5.6L(标准状况).
点评 本题考查根据方程式的有关计算,比较基础,旨在考查学生对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 用CO2合成可降解的聚碳酸酯塑料,能减少白色污染及其危害 | |
| C. | 推广使用煤的液化技术,从根本上减少二氧化碳等温室气体的排放 | |
| D. | 明矾常用于水体杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
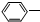 )
)
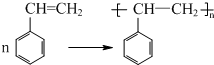 (不要求写出反应条件)
(不要求写出反应条件)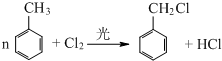 (要求写出反应条件)
(要求写出反应条件)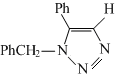 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .亚硫酸钡溶于稀硝酸中:BaSO3+2H+═Ba2++SO2↑+H2O | |
| B. | 向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 向水玻璃中通入少量CO2:SiO32-+2CO2+3H2O═H4SiO4↓+2HCO3- | |
| D. | 用NaOH溶液吸收废气中的氮氧化物:NO+NO2+2OH-═2NO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
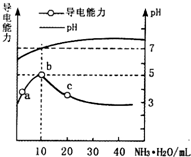 常温下,向10ml 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析不正确的是( )
常温下,向10ml 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析不正确的是( )| A. | a~b点导电能力增强,说明HR为弱酸 | |
| B. | b点溶液pH=5,此时酸碱恰好中和 | |
| C. | c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | |
| D. | b~c任意点溶液均有c(H+)•c(OH-)=Kw=1.0×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com